Pengertian Rumus Molekul, Soal dan Pembahasannya
Gurubagi.com. Rumus molekul merupakan rumus yang meyatakan jenis dan jumlah yang sesungguhnya dari atom-atom yang menyususn suatu molekul yang dinyatakan dengan lambang unsur-unsurnya.
Dengan kata lain rumus molekul dapat diartikan sebagai kelipatan dari rumus empirisnya. Untuk menyatakan rumus molekul suatu zat dilakukan dengan cara menuliskan lambang kimia tiap unsur yang ada dalam molekul dan jumlah atom.
jumlah atom trsebut dituliskan di kanan lambang kimia unsur secara subscript atau biasa disebut dengan angka indeks.

Rumus molekul menyatakan jenis dan jumlah atom yang sebenarnya di dalam molekul suatu senyawa.
Contohnya glukosa mempunyai rumus molekul C6H12O6, yaitu setiap molekul glukosa mengandung enam atom karbon (C), dua belas atom hidrogen (H), dan enam atom oksigen (O).
Rumus molekul bisa dibagi menjadi dua, yaitu rumus molekul unsur dan rumus molekul senyawa.
1. Rumus Molekul Unsur
Rumus molekul unsur merupakan rumus yang menyatakan gabungan atom-atom yang sama, lalu jadi molekul.
Jika dilihat dari jumlah atom yang bergabung, molekul unsur ini terbagi menjadi dua, yaitu molekul diatomik dan poliatomik.
a. Molekul diatomik
Molekul diatomik itu adalah molekul yang terbentuk dari dua atom yang sama.Jumlah atomnya dinyatain dengan angka indeks. Contoh dari molekul diatomik, yaitu oksigen (O2), nitrogen (N2), dan hidrogen (H2).
Baca :
- Pengertian Rumus Kimia, Rumus Molekul, Rumus Empiris, beserta Contohnya
- Pengertian Rumus Empiris, Contoh Soal dan Pembahasannya
b. Molekul poliatomik
Molekul poliatomik adalah molekul yang terdiri dari tiga atom atau lebih yang terbentuk jadi molekul. Contohnya: ozon (O3).
Jika diuraikan berdasarkan sifatnya molekul unsur memiliki sifat sebagai berikut.
- Gabungan 2 atom atau lebih yang berasal dari unsur sama.
- Tidak dapat diuraikan menjadi zat yang lebih sederhana dengan reaksi kimia biasa.
- Perbandingan massa unsur-unsur penyusunnya tidak tetap.
2. Rumus Molekul Senyawa
Rumus molekul senyawa adalah rumus senyawa yang tersusun dari dua atom atau lebih yang berbeda dan membentuk molekul.
Contohnya:
a. Karbon dioksida (CO2).tersusun dari 1 tom krbon dan 2 atom oksigen
b. Etilen (C2H4) yang berarti etilen tersusun atas 2 atom karbon dan 4 atom hidrogen
Jika diuraikan berdasarkan sifatnya molekul senyawar memiliki sifat sebagai berikut.
- Gabungan 2 atau lebih atom dari unsur yang berbeda.
- Unsur penyusunnya dapat diuraikan dengan reaksi kimia biasa.
- Perbandingan massa unsur-unsur penyusunnya selalu tetap.
Rumus molekul dapat ditentukan dengan cara:
1. Menentukan empirical formula senyawa
2. Menentukan Mr senyawa jika belum diketahui.
3. Menentukan nilai kelipatan empirical formula dari Mr senyawa dan Mr empirical formula dengan persamaan berikut:

4. Kalikan nilai n dengan RE untuk mendapatkan RM senyawa.
Contoh soal rumus molekul
Soal nomor 1
Suatu senyawa mempunyai rumus empiris (CH2O)n dengan massa molekul relatif 180 (Ar C =121, H = 1, O = 16). Tentukan rumus molekul senyawa tersebut!
Pembahasan :
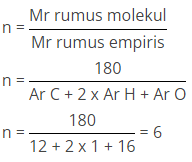
Rumus molekul (CH2O)n = (CH2O)6 = C6H12O6
Soal nomor 2
Suatu senyawa hidrokarbon mengandung 48 gram C serta 8 gram H (Ar C = 12, Ar H = 1). Carilah rumus molekul senyawa itu apabila diketahui massa molekul relatifnya ialah 28!
Pembahasan :
Langkah pertama yang perlu anda lakukan ialah mencari terlebih dahulu rumus empirisnya. Adapun caranya ialah dengan rumus sebagai berikut.

nC : nH = mC/ArC : mH/ArH
Sehingga nC : nH = 48/12 : 8/1
nC : nH = 4 : 8
nC : nH = 1 : 2
Jadi, rumus empiris senyawa itu adalah CH2.
Dari rumus empiris senyawa CH2 bisa dicari Mr-nya.
Berikut caranya.
Mr CH2 = (1 x Ar C) + 2 (x Ar H) = (1 x 12) + (2 x 1)
Hasilnya Mr CH2 = 14
Rumus molekul bisa ditentukan dengan rumus sebagai berikut.
Mr rumus molekul = n dikali (Mr rumus empiris)
28 = n x 14
n = 28 14
= 2
Jadi, rumus molekul senyawa itu adalah (CH2)2 = C2H4
Demikian pengertian rumus molekul, soal dan pembahasannya. Semoga bermanfaat.