Pemahaman Hukum Hess disertai Contoh Soal dan Pembahasan
Gurubagi.com. Pada tahun 1840, kimiawan asal Rusia kelahiran Swiss bernama Germain Henri Hess, melakukan manipulasi terhadap persamaan termokimia untuk menghitung ΔH yang terdapat dalam sebuah hukum yang dinamai dengan hukum Hess.
Gerrmain Henry Hess menyatakan bahwa : “Apabila sebuah reaksi berlangsung dalam dua tahap reaksi atau pun lebih, maka perubahan entalpi terhadap reaksi tersebut akan bernilai sama dengan jumlah perubahan entalpi dari seluruh tahapan yang terjadi”.
Hukum Hess adalah hukum yang digunakan untuk menentukan besarnya perubahan entalpi suatu reaksi. Dalam hukum Hess, nilai perubahan entalpi dinyatakan sebagai fungsi keadaan (∆H).
Menurut hukum ini, karena perubahan entalpi merupakan fungsi keadaan maka perubahan reaksi kimia akan bernilai sama meskipun langkah-langkah yang diperlukan untuk menghasilkan hasil reaksi berbeda.
Dari Hukum Hess yang telah disebutka sebelumnya, perubahan entalpi pada suatu reaksi memungkinkan untuk dihitung berdasarkan pada perubahan entalpi dari reaksi lain yang nilainya telah diketahui. Hal ini bisa dilakukan supaya peneliti tak usah melakukan eksperimen setiap waktu.
Baca : Pengaruh Luas Permukaan Bidang Sentuh Terhadap Laju Reaksi
Konsep dari hukum Hess juga dapat diperluas untuk menghitung perubahan fungsi keadaan lainnya, seperti entropi dan energi bebas.
Kedua aplikasi ini amat berguna karena besaran-besaran tersebut sulit atau tidak bisa diukur secara langsung, sehingga perhitungan dengan hukum Hess digunakan sebagai salah satu cara menentukannya. Berikut ini gambaran skematis Hukm Hess
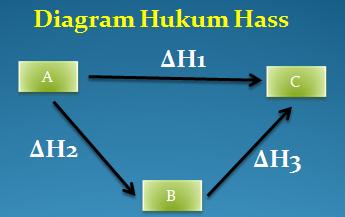

Perubahan dari A menjadi C bisa berlangsung melalui 2 tahap yaitu:
Tahap I (secara Iangsung)
A → C → ∆H1
Tahap II (secara tidak langsung)
Berdasarkan Hukum Hess maka harga ∆H1 = ∆H2 + ∆H3
Contoh Soal dan Pembahasan Hukum Hess
- Tentukah ΔH dari diagram di bawah ini:
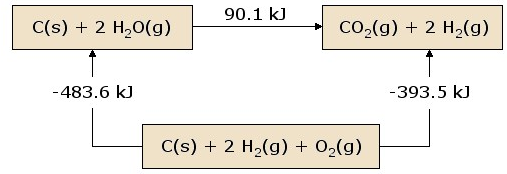
Perhatikan gambar di atas bahwa jika C(s) + 2H2 (g) + O2 (g) direaksikan menjadi CO2 (g) + 2H2 (g) mempunyai perubahan entalpi sebesar -393,5 kJ.
Meskipun terdapat reaksi dua langkah, tetap saja perubahan entalpi akan selalu konstan :
(-483,6 kJ + 90,1 kJ = -393,5 kJ).
2. Perhatikan diketahui diagram tingkat energi berikut!
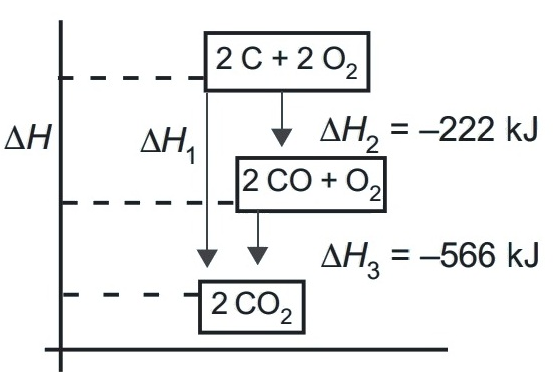
Tentukan entalpi standar pembentukan gas CO2!
Penyelesaian:
Berdasarkan Hukum Hess
∆H1 = ∆H2 + ∆H3
∆H1 = -222 + (-566)
∆H1 = -788 kJ
∆H0f CO2 = -788/2 = -394 kJ/mol
Demikian pemahaman Hukum Hess disertai contoh soal dan pembahasan. Semoga bermanfaat
