Persamaan Termokimia, Perubahan Entalpi Standar dan Contoh Soalnya
Gurubagi.com. Persamaan termokimia digunakan untuk menginformasikan reaksi tentang perubahan kalor (panas) suatu zat yang melibatkan proses kimia dan fisika.
Persamaan termokimia adalah persaman reaksi setara yang menyertakan kalor reaksi (entalpi reaksi) yang menunjukkan hubungan antara massa dan energi.
Contoh persamaan termokimia : 2H2(g) + O2(g) → 2H2O(g) ΔH= −483,6 kJ
Entalpi H, yaitu fungsi keadaan yang merupakan jumlah dari energi dalam (E) dan hasil kali dari tekanan (P) dan volum (V) sistem.
Pada tekanan konstan, perubahan entalpi, ΔH, yang terjadi dalam suatu reaksi disebut juga sebagai entalpi reaksi (ΔHrx) memiliki nilai yang sama dengan kalor reaksi (q).
Entalpi reaksi (ΔHrx) juga merupakan fungsi keadaan, yang nilainya bergantung pada Hakhir dan H awal. Dalam suatu reaksi kimia, “akhir” dan “awal” bisa dinyatakan sebagai “produk” dan “reaktan.”
Jadi, produk dapat lebih dari ataupun kurang dari Reaktan sehingga tanda nilai ΔHrx bergantung pada apakah kalor diserap atau dilepas oleh sistem reaksi.
Sistem, Lingkungan, Energi dan Kalor
Sistem merupakan kumpulan atau objek apa saja uang diteliti atau diamatu yang menjadi pusat perhatian. Sedangkan lingkungan yaitu benda-benda yang berada diluar sistem tersebut. Sistem kimia adalah campuran pereaksi yang kita amati,
Contoh Penerapan Sistem dan Lingkungan:
Ke dalam gelas kimia yang berisi air, dilarutkan 10 g gula pasir. Jika gula pasir ditetapkan sebagai sistem, manakah yang termasuk lingkungan?
Pembahasan :
Karena gula pasir dipandang sebagai sistem maka selain dari gula pasir termasuk lingkungan, seperti air sebagai pelarut, gelas kimia, penutup gelas kimia, dan udara di sekelilingnya.
Berikut ini tiga jenis sistem berdadarkan jenis pertukaran yang terjadi antara sistem dan lingkngan.
a. Sistem terbuka
Sistem yang mengakibatkan terjadinya pertukaran energi yaitu panas dan kerja serta materi dengan lingkungan. Contoh saat merebus air dipanci tanpa ditutup.
b. Sitem tertutup
Sistem yang mengakibatkan terrjadinya pertukaran energi (pansa dan kerja), akan tetapi tidak terjadi pertukaran zat dengan lingkungan. Air pada gelas tertutup merupakan salah satu contoh sistem tertutup yaituteerjadi pertukaran panas dsan kerjs akan ettapi tidak terjadi pertukaran zat dengan lingkungan.
c. Sistem terisolasi
Sistem yang tidak mengakibatkan terjadi pertukaran panas, zat atau kerja dengan lingkungannya, contoh air tang disimpan dalam termos.
Setiap materi zat memiliki energi yang berbeda di dalamnya dengan berbagai bentuk energi. Kalor adalah energi yang berpindah dari sistem ke lingkungan atau sebaliknya, dari suhu yang lebih tinggi ke suhu yang lebih rendah.
Apabila suatu zat menyerap kalor, suhu zat akan naik, begitu juga sebaliknya. Jika suatu zat melepaskan kalor, maka suhu zat tersebut akan turun.
Jumlah kalor yang diserap atau dibebaskan oleh suatu sistem dapat ditentukan melalui percobaan. Kalor jenis adalah kalor yang diperlukan untuk menaikn suhu 1 gram zat sebanyak 1 K atau 1⁰C.
Apabila massa da kalor atau kapasotas kalor sistem tersebut diketahui, besarnyabkalor dapat dihitung dengan rumus berikut :
Q = m.c.ΔT
Keterangan:
- Q : banyaknya kalor yang diterima atau dilepas oleh suatu benda (J)
- m : massa benda yang menerima atau melepas kalor (kg)
- c : kalor jenis zat (J/kg⁰C)
- ΔT : perubahan suhu (⁰C)
Rumus Kalor Jenis: c = Q / m.ΔT
Keterangan:
- c = kalor jenis zat (J/kg⁰C)
- Q = banyaknya kalor yang dilepas atau diterima oleh suatu benda (Joule)
- m = massa benda yang menerima atau melepas kalor (kg)
- ΔT = perubahan suhu (⁰C)
Rumus Kapasitas Kalor: C = Q / ΔT
Keterangan:
- C = kapasitas kalor (J/K)
- Q = banyaknya kalor (J)
- ΔT = perubahan suhu (K)
Selain itu, ada rumus lain untuk menentukan kapasitas kalor itu sendiri, yaitu: C = m. c
Keterangan:
- C = kapasitas kalor (J/K)
- m = massa benda yang menerima atau melepas kalor (kg)
- c = kalor jenis zat (J/kg.K)
Contoh Soal nomor 1
Air sebanyak 3 kg bersuhu 10oC dipanaskan hingga bersuhu 35oC. Jika kalor jenis air 4.186 J/kgoC, maka tentukan kalor yang diserap air tersebut?
Pembahasan:
Diketahui:
m = 3 kg
c = 4.186 J/kgoC
∆T = (35 – 10)oC = 25oC
Ditanyakan: Q = ?
Jawab:
Q = mc∆T
Q = 3 kg × 4.186 J/kgoC × 25oC
Q = 313.950 J
Contoh soal nomor 2
Sebanyak 300 gram air dipanaskan dari suhu 30oC menjadi 50oC. Jika kalor jenis air adalah 1 kal/goC atau 4.200 J/kg K, tentukan:
a. Banyaknya kalor yang diterima air tersebut (dalam kalori).
b. Banyaknya kalor yang diterima air tersebut (dalam joule).
Pembahasan:
Diketahui:
m = 300 g = 0,3 kg
∆T = 50oC – 30oC = 20oC
c = 1 kal/goC = 4.200 J/kg K
Ditanyakan: Q dalam kalor dan joule
Jawab:
a. Menentukan jumlah kalor dalam kalori
Q = mc∆T
Q = 300 g × 1 kal/goC × 20oC
Q = 6.000 kalori
Jadi, banyaknya kalor yang diterima air tersebut adalah 6.000 kalori.
b. Menentukan jumlah kalor dalam joule
Q = mc∆T
Q = 0,3 kg × 4.200 J/kg K × 20 K
Q = 6.000 kalori
1 kalori = 4,2 joule sehingga:
maka Q = 6.000 × 4,2 joule = 25.200 joule
Hukum kekalan energi dikenal dengan hukum termodinamika I, yang berbunyi “untuk setiap proses apabila kalor Q diberikan kepada sistem dan sistem melakukan usaha W’, Sehingga besar energi ini dapat ditentukan dengan rumus:
ΔU = Q – W
Dengan ketentuan, sebagai berikut jika:
- Q(+) → sistem menerima kalor
- OR → sistem melepas kalor
- W(+) → sistem melakukan usaha
- W(-) → sistem dikenai usaha
- ∆U(+) → terjadi penambahan energi dalam
- ∆U(-) → terjadi penurunan energi dalam
ΔU = Q − W
Keterangan :
ΔU = perubahan energi dalam (joule)
Q = kalor (joule)
W = usaha (joule)
Baca : Pengertian Laju Reaksi, Rumus, dan Faktor-faktor yang Memengaruhinya
Reaksi Eksoterm dan Reaksi endoterm
1. Reaksi Eksoterm
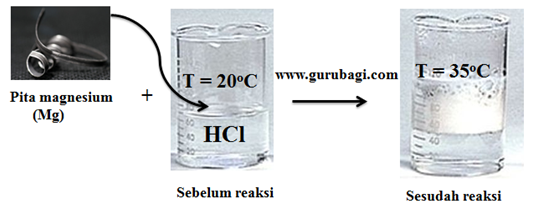
Reaksi eksoterm adalah reaksi yang melepaskan kalor (panas) dari sistem ke lingkungan. Entalpi sistem sebelum reaksi lebih besar daripada sesudah reaksi, maka perubahan entalpi sistem negatif. Entalpi sistem berkurang, sehingga harga ∆H = negatif (-)

Diagram tingkat energi eksoterm
Ciri-ciri reaksi eksoterm, yaitu:
- Kalor mengalir dari sistem ke lingkungan
- Entalpi produk lebih kecil dari pada entalpi pereaksi
- Perubahan entalpinya bertanda negatif
2. Reaksi Endoterm
Reaksi Endoterm adalah reaksi yang menyerap kalor (panas) dari lingkungan ke sistem. Entalpi sistem sesudah reaksi lebih besar daripada entalpi sistem sebelum reaksi. Maka perubahan entalpi positif . Entalpi sistem bertambah (∆H = +)


Diagram tingkat energi Endoterm
Ciri-ciri reaksi endoterm, yaitu:
- Kalor mengalir dari lingkungan ke sistem
- Entalpi produk lebih besar dari pada entalpi pereaksi
- Perubahan entalpinya bertanda positif
Penentuan Perubahan Entalpi Reaksi
Perubahan entalpi yang menyertai reaksi tersebut dinamakan dengan entalpi reaksi. Entalpi (H) dipahami sebagai jumlah energi suatu sistem pada kondisi tekanan tetap.
Perubahan Entalpi (∆H)
Entalpi merupakan sifat ekstensif zat yang dapat digunakan untuk menentukan perubahan kalor dalam reaksi kimia. Nilai dari entalpi sendiri tidak dapat diukur. Akan tetapi perubahan kalor yang terjadi pada saat reaksi berlangsung dapat diukur.
Perubahan kalor yang terjadi dalam reaksi kimia disebut perubahan entalpi (∆H). Pada tekanan konstan, perubahan entalpi sama dengan jumlah kalor reaksi yang dilepaskan atau diserap oleh sistem.
1.Perubahan entalpi pembentukan standar (ΔHfo)
Perubahan entalpi pembentukan standar adalah perubahan entalpi pada pembentukan 1 mol senyawa dari unsur-unsurnya yang berada dalam keadaan yang paling stabil pada keadaan standar (1 atm, 25oC) . Satuan ΔHfo adalah kJ per mol senyawa yang terbentuk (ditulis kJ/mol).

ΔHfo wujud cair berbeda dengan ΔHfo wujud air dalam wujud padat
2. Perubahan entalpi penguraian standar (ΔHdo)
Perubahan entalpi standar penguraian adalah perubahan entalpi standar pada penguraian 1 mol senyawa menjadi unsur-unsurnya.
Perubahan entalpi penguraian standar (ΔHdo) adalah kebalikan dari Perubahan entalpi pembentukan standar (ΔHfo), sehingga nilai ΔHdo= – ΔHfo

3. Perubahan entalpi peleburan standar (ΔHofus)
Perubahan entalpi peleburan standar adalah perubahan entalpi yang berkaitan dengan peleburan 1 mol zat dalam fase padat menjadi zat dalam fase cair pada titik leburnya dan tekanan 1 atm. Sebagai

4. Perubahan entalpi pembakaran standar (ΔHco)
Perubahan entalpi pembakaran standar adalah perubahan entalpi standar pada pembakaran sempurna 1 mol zat. Contoh:

5. Perubahan entalpi penguapan standar (ΔHovap )
Perubahan entalpi penguapan standar adalah perubahan entalpi standar reaksi pada penguapan 1 mol zat dalam fase cair menjadi zat dalam fase gas pada titik didihnya. Sebagai contoh:
![]()
Penentuan Perubahan Entalpi Reaksi
1. Penentuan Reaksi ΔH Reaksi berdasarkan eksperimen (Kalorimeter)
Penentuan kalor reaksi secara kalorimeter merupakan penentuan yang didasarkan atau diukur dari perubahan suhu larutan dan kalorimeter dengan prinsip perpindahan kalor yaitu jumlah kalor yang diberikan sama dengan jumlah kalor yang diserap.
Kalorimeter merupakan suatu sistem terisolasi sehingga tidak memungkinkan terjadinya pertukaran energi dan materi antara sistem dengan lingkungan
Oleh karena itu, kalorimeter dapat digunakan untuk menentukan jumlah kalor yang diserap oleh air dan perangkat kalorimeter. Semua kalor yang dilepaskan oleh sistem tidak ada yang terbuang ke lingkungan.
Proses pengukuran kalor reaksi dengan kalorimeter dinamakan kalorimetri.
Rumus yang berlaku untuk menentukan besar (jumlah) kalor dalam kalorimeter:
q = m . C . ∆T
Keterangan:
q = jumlah kalor (joule)
m = massa zat (g)
c = kalor jenis (Jg-1 °C-1)
ΔT = perubahan suhu (Takhir – Tawal)(°C)
Kalor jenis (c) merupakan jumlah kalor yang diperlukan untuk menaikkan 1 g zat sebesar 1 °C atau 1 K. Sementara itu, kapasitor panas (C) merupakan jumlah panas yang dibutuhkan untuk menaikkan suhu sebesar 1°C.
q = C • ΔT
ΔH = -q/mol
Keterangan:
q = jumlah kalor (joule)
C = kapasitas kalor (J°C_1)
ΔT = perubahan suhu (°C)
ΔH = perubahan entalpi
Contoh Penerapan
Ke dalam 50 mL larutan tembaga (II) sulfat 0,4 M ditambahkan serbuk zink (sedikit berlebihan), ternyata suhunya naik 20°C. Dengan menganggap bahwa kalor jenis larutan sama dengan kalor jenis air, yaitu 4,18 j/g K dan kapasitas kalor wadah reaksi dapat diabaikan, maka tentukanlah ∆Hreaksi : (Massa jenis larutan 1 kg/L = 1 gr/ mL)
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
Pembahasan :
Diketahui :
50 ml ZnSO4 0,4 M
∆T = 20°C = 20 + 273 = 293 K
c = 4,18 j/g K
Ditanya : ∆H reaksi = ?
Jawab:
m larutan = 50 mL x 1 gr/mL = 50 gram
q larutan = m x c x ∆T
= 50 gram x 4,18 j/g K x 293° K
=61.237 j
= 61,237 kJ
q reaksi = – q larutan = – 61,237 kJ
Kalor reaksi diatas adalah kalor reaksi yang dilepaskan pada reaksi 50 mL ZnSO4 0,4 M atau :
mol ZnSO4 = M x V = 0,4 M x 0,05 L = 0,02
Perhatikan reaksi : Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
Jumlah Zn dan CuSO4 yang bereaksi sesuai dengan persamaan rekasi diatas adalah 1 mol, sehingga : ∆H reaksi = 1/0,02 x – 61,237 = – 3.061,85 kJ
Persamaan termokimia :
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s) ∆H = – 3.061,85 kJ
2. Penentuan ΔH Reaksi Berdasarkan Data Entalpi Pembentukan Standar
Penentuan harga perubahan entalpi reaksi (ΔHr) berdasarkan data entalpi pembentukan standar (ΔH°f) dihitung dengan cara menentukan selisih entalpi pembentukan standar (ΔH°f) antara produk dan reaktan,
Perubahan entalpi reaksi dapat dihitung dengan rumus berikut.
Reaksi : Reaktan ——-> Produk
ΔHºreaksi = ΣΔHºf (produk) – ΣΔHºf (reaktan)
Contoh Penerapan
Soal no 1
Diketahui entalpi pembentukan :
ΔHof Al2O3 = – 1669,8 kJ/mol
ΔHof Fe = +12,40 kJ/mol
ΔHofvFe2O3 = -822,2 kJ/mol
Tentukan ΔH reaksi termit yang melibatkan aluminium dan besi (III) oksida berikut.
Al(s) + Fe₂O₃(s) → Al₂O₃(s) + 2Fe(l)
Pembahasan:
ΔHorx = [ΔHof (Al2O3) + 2ΔHof (Fe)] – [2ΔHof (Al) + ΔHof (Fe2O3)]
= [(-1669,8 kJ/mol) + 2(12,40 kJ/mol)] – [2(0) + (-822,2 kJ/mol)]
= -822,8 kJ/mol
3. Penentuan ΔH Reaksi Berdasarkan Hukum Hess
Pada tahun 1840, G.H Hess melakukan penelitian bahwa perubahan entalpi reaksi yang tidak dapat ditentukan dengan cara kalorimeter dapat ditentukan dengan perhitungan.
Hukum Hess berbunyi : Perubahan entalpi reaksi hanya bergantung pada keadaan awal dan keadaaan akhir, tidak bergantungpada jalannya bereaksi
Hukum tersebut dapat digunakan untuk menghitung jumlah entalpi keseluruhan proses reaksi kimia walaupun menggunakan rute reaksi yang berbeda.
Hukum Hess dapat digambarkan secara skematis seperi dibawah ini. Perhatikan gambar reaksi A → C.

Perubahan A → C dapat berlangsung dengan 2 tahap, yaitu.
Tahap I (secara Iangsung)
A → C → ∆H1
Tahap II (secara tidak langsung)
Berdasarkan Hukum Hess maka harga ∆H1 = ∆H2 + ∆H3
A → B = ∆H2
B → C = ∆H3
A → C = ∆H2 + ∆H3
Contoh Penerapan
Jika perubahan kimia terjadi pada beberapajalur yang berbeda, maka perubahan entalpi pada keseluruhan juga sama. Maka untuk itu ΔH pada reaksi tungga dapat di rumuskan:
Diketahui diagram siklus Hess

Tentukan entalpi standar pembentukan gas CO2 dari siklus diatas!
Pembahasan :
Menurut Hukum Hess:
∆H1 = ∆H2 + ∆H3 = –222 + (–566) kJ = –788 kJ
maka ∆Hf° gas CO2 = – (788/2) = –394 kJmol–1
4. Energi iktan rata-rata
Jumlah energi yang diperlukan untuk memutuskan 1 mol suatu ikatan antar atom disebut energi ikatan. Sebelum zat produk terbentuk, maka ikatan atom-atom senyawa pada zat reaktan terlebih dahulu diputuskan dan terjadi pembentukan produk.
∆H reaksi dapat ditentukan dengan rumus sebagai berikut.
∆Hreaksi = ∑energi ikatan yang diputuskan – ∑energi ikatan yang dibentuk
Contoh Penerapan
Diketahui energi ikatan:
C – H = 415 kJ/mol
C = C = 607 kJ/mol
C – C = 348 kJ/mol
H – H = 436 kJ/mol
Hitunglah ΔHreaksi pada reaksi : C2H4(g) + H2(g) → C2H6(g)
Pembahasan:
Perhatikan ikatan yang terjadi antara atom dalam reaksi diatas

ΔHreaksi = Σ energi pemutusan ikatan – Σ energi pembentukan ikatan
= {4 (C – H) + (C = C) + (H – H)} – {6 (C – H) + (C – C)}
= {(C = C) + (H – H)} – {2 (C – H) + (C – C)}
= (607 + 436) – (2 × 415 + 348)
= 1.043 – 1.178
= –135 kJ
Jadi, C2H4(g) + H2(g) → C2H6(g) ΔH = –135 kJ
Demikian materi Persamaan Termokimia, Perubahan Entalpi Standar dan Contoh Soalnya. Semoga bermanfaat