Pengertian Rumus Kimia, Rumus Molekul, Rumus Empiris, beserta Contohnya
Gurubagi.com. Rumus kimia suatu zat menyatakan komposisi dari partikel terkecil penyusun zat tersebut, yang dinyatakan dengan lambang unsur serta perbandingan jumlah atom-atom penyusun partikel tersebut.
Jumlah atom-atom penyususn partikel tersebut dinyatakan dengan angka (angka 1 tidak ditulis). Jadi dalam rumus kimia terdapat lambang unsur dan terkadang disertai angka indeks.
Angka indeks yaitu jumlah atom dituliskan di kanan lambang kimia unsur secara subscript atau di bawah kanan ditulis kecil di bawah atom yang bersangkutan .
Rumus kimia zat terbagi menjadi dua, yaitu: Rumus molekul Rumus molekul adalah rumus yang menyatakan jumlah atom-atom dari unsur yang menyusun satu molekul senyawa.
Rumus Molekul
Rumus molekul adalah rumus yang meyatakan jenis dan jumlah yang sesungguhnya dari atom-atom yang menyususn suatu molekul yang dinyatakan dengan lambang unsur-unsurnya.
Rumus molekul bisa dibagi menjadi dua, yaitu rumus molekul unsur dan rumus molekul senyawa.
1. Rumus Molekul Unsur
Rumus molekul unsur merupakan rumus yang menyatakan gabungan atom-atom yang sama, lalu jadi molekul.
Baca : Perangkat Ajar Materi Kimia Kelas 10 SMA Kurikulum Merdeka
Jika dilihat dari jumlah atom yang bergabung, molekul unsur ini terbagi menjadi dua, yaitu molekul diatomik dan poliatomik.
a. Molekul diatomik
Molekul diatomik itu adalah molekul yang terbentuk dari dua atom yang sama.Jumlah atomnya dinyatain dengan angka indeks. Contoh dari molekul diatomik, yaitu oksigen (O2), nitrogen (N2), dan hidrogen (H2).
b. Molekul poliatomik
Molekul poliatomik adalah molekul yang terdiri dari tiga atom atau lebih yang terbentuk jadi molekul. Contohnya: ozon (O3).
Jika diuraikan berdasarkan sifatnya molekul unsur memiliki sifat sebagai berikut.
- Gabungan 2 atom atau lebih yang berasal dari unsur sama.
- Tidak dapat diuraikan menjadi zat yang lebih sederhana dengan reaksi kimia biasa.
- Perbandingan massa unsur-unsur penyusunnya tidak tetap.
2. Rumus Molekul Senyawa
Rumus molekul senyawa adalah rumus senyawa yang tersusun dari dua atom atau lebih yang berbeda dan membentuk molekul.
Contohnya:
a. Karbon dioksida (CO2).tersusun dari 1 tom krbon dan 2 atom oksigen
b. Etilen (C2H4) yang berarti etilen tersusun atas 2 atom karbon dan 4 atom hidrogen
Jika diuraikan berdasarkan sifatnya molekul senyawar memiliki sifat sebagai berikut.
- Gabungan 2 atau lebih atom dari unsur yang berbeda.
- Unsur penyusunnya dapat diuraikan dengan reaksi kimia biasa.
- Perbandingan massa unsur-unsur penyusunnya selalu tetap.
Rumus Empiris
Rumus empiris adalah rumsu yang menunjukan jenis dan perbandingan paling sederhana dari atom-atom penyusun zat.
Rumus kimia senyawa ion merupakan rumus empiris. Misalnya, natrium klorida merupakan senyawa ion yang terdiri atas ion Na+ dan ion Cl– dengan perbandingan 1:1. Rumus kimia natrium klorida adalah NaCl.
Pada kondisi lain, sebagian unsur-unsur ada yang membentuk molekul-molekul, sehingga, semua senyawa yang memiliki rumus molekul, pasti memiliki rumus empiris.
Sedangkan yang memiliki rumus empiris, belum tentu memiliki rumus molekul. Perhatikan perbedaan rumus empiris dan rumus molekul dari contoh dibawah ini.
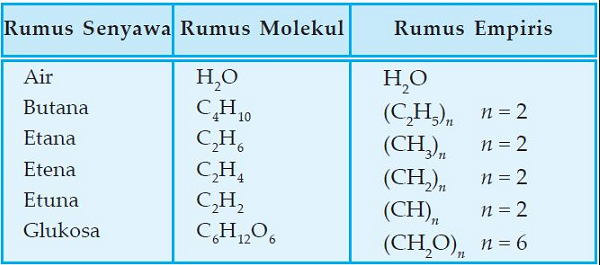
Dari contoh diatas H2O (air) karena rumus molekunya sudah dengan perandingan yang sederhana, maka rumus molekulnya sama dengan rumus empirisnya. Sedangkan rumus molekul C2H10 masih dapat disederhanakan menjadi dengan rumus empiris C2H5.
Demikian pengertian rumus kimia, rumus molekul, rumus empiris, beserta contohnya. Semoga bermanfaat.