Pengertian Sifat Koligatif Larutan dan Klasifikasinya
Gurubagi.com. Kata koligatif berasal dari Bahasa Latin, yaitu dari kata colligareyang berarti berkumpul bersama, sebelum membahas sifat koligatif larutan kita pahami terlebih dahulu tentang larutan.
Jika kalian melarutkan gula, terdapat zat pelarut dalam hal ini air yang jumlahnya lebih banyak dan zat terlarut yaitu gula, sehigga jika di campur menjadi satu air dan gula disebut dengan larutan
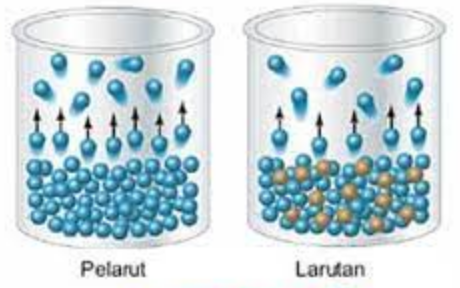
Larutan merupakan campuran homogen yang membentuk satu fase. Untuk meyatakan komposisi larutan secara kuantitatif, digunan konsentrasi.

Perhatikan ketiga gambar di atas, gambar tersebut memiliki jenis zat terlarut dan ukuran zat terlarut yang beda. Akan tetapi, jumlah partikel zat terlarutnya sama.
Maka dapat disimpulkan yang dimaksud dengan sifat koligatif larutan adalah sifat larutan yang dipengaruhi oleh jumlah partikel zat dan tidak tergantung dari sifat zat terkarut atau tidak bergantung pada jenis dan ukuran zat terlarut.
Jumlah partikel zat terlarut dalam suatu larutan dinyatakan dalam suatu besara konsentrasi larutan Jadi, semaikin banyak jumlah zat terlarut, maka sifat koligatif larutan akan semakin besar.
Konsetrasi larutan yang di bahas disini terdapat tiga jenis, yaitu
1. Molaritas
Molaritas merupakan banyaknya mol zat yang terlarut dalam satu liter larutan. Berikut rumus yang digunakan dalam menghitung molaritas.

Keterangan:
M = molaritas (M)
n = mol zat (mol)
V = volume (L atau mL)
ρ = massa jenis (gr/mL)
m = massa terlarut (gr)
Mr = molekul relatif (gr/mol)
% = persen kadar zat
2. Molalitas (m)
Molalitas (m) menyatakan banyaknya molzat terlarut dalam setiap 1.000 gram pelarut. Berikut rumus molalitas.
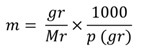
Keterangan:
m = molalitas (m)
p = massa pelarut (gr)
gr = massa terlarut (gr)
Mr = molekul relatif (gr/mol)
3. Fraksi Mol (X)
Fraksi mol (X) menyatakan perbandingan banyaknya mol dari zat pelarut dan pelarut terhadap jumlah mol seluruh komponen dalam larutan. Dalam suatu larutan terdapat 2 fraksi mol, yakni fraksi mol terlarut (Xt) dan fraksi mol pelarut (Xp). Berikut rumus fraksi mol.
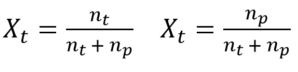
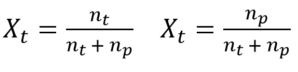
Keterangan
Xt = fraksi mol terlarut
nt = mol terlarut
Xp = fraksi mol pelarut
np = mol pelarut
p = massa pelarut (gr)
Klaisfikasi Sifat koligatif larutan
Klasisifikasi sifat koligaif larutan dibagi empat, diantaranya penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik.
Pada sistem pelarut murni titik didih, titik beku, tekanan uap, dan tekanan osmotik hanya akan dapat dipengaruhi oleh molekul pelarut itu sendiri.
Hal tersebut berbeda dengan sistem pelarut yang terdiri dari pelarut dan terlarut,. Keberadaan zat terlarut dalam suatu pelarut akan menyebabkan suatu perubahan tertentu pada keempat sifat pelarut tersebut.
Zat terlarut volatil mengakibatkan tekanan uap jenuh larutan lebih besar dari tekanan uap jenuh pelarut. Sedangkan, zat terlarut non volatile cenderung menurunkan tekanan uap jenuh larutan. Perubahan tekanan uap akan berdampak pada titik didih dan titik beku larutan sehingga terjadi sifat koligatif larutan.
Berikut ini penjelasan lebih rinci mengenai klasifikasi sifat koligatif larutan.
1. Penurunan tekanan uap (∆P)
Penguapan merupakan peristiwa yang terjadi ketika partikel-partikel zat cair meninggalkan kelompoknya. Semakin lemah gaya tarik-menarik antarmolekul zat cair maka semakin mudah zat cair tersebut menguap. Semakin mudah zat cair menguap maka semakin besar pula tekanan uap jenuhnya.
Tekanan uap merupakan jumlah atau banyaknya uap yang terbentuk di atas permukaan zat cair. Ketika partikel-partikel zat cair meninggalkan kelompoknya menjadi uap. Di waktu bersamaan, uap tersebut akan kembali menjadi zat cair.
Adapun tekanan uap jenuh merupakan tekanan yang muncul ketika terjadi kesetimbangan antara jumlah partikel zat cair menjadi uap dan jumlah uap menjadi zat cair.
Pada tahun 1880-an, F. M. Raoult, seorang ahli kimia Prancis menyatakan Hukum Raoult yang dapat dirumuskan sebagai berikut.
ΔP = Xt . Pᵒ
Jika tekanan uap pelarut di atas larutan dilambangkan P maka ∆P = Po – P
Jika komponen larutan terdiri pelarut dan zat terlarut dengan tetapan rumus berikut:
Xp + Xt = 1 , maka Xt = 1 – Xp.
Persamaan akan menjadi
ΔP = Xt . Pᵒ
Pᵒ – P = (1 – Xp) Pᵒ
Pᵒ – P = Pᵒ – Xp . Pᵒ
Keterangan :
ΔP = Penurunan tekanan uap (mmHg)
Xp = Fraksi mol pelarut
Xt = Fraksi mol terlarut
P° = Tekanan uap jenuh pelarut murni (mmHg)
P = Tekanan uap larutan (mmHg)
2. Kenaikan titik didih (∆Tb)
Titik didih zat cair adalah suhu tetap ketika zat cair mendidih. Pada suhu itu, tekanan uap zat cair sama dengan tekanan udara di sekitarnya. Hal tersebut mengakibatkan munculnya penguapan di seulur bagian zat cair.
Titik didih zat cair dikur dengan tekanan 1 atmosfer. Titik didih larutan selalu lebih tinggi dari titik didih pelarut murninya, karena adanya partikel-partikel zat terlarut dalam suatu larutan menghalangi peristiwa penguapan partikel-partikel pelarut.
Oleh sebab itu, penguapan partikel-partikel pelarut membutuhkan energi yang lebih besar. Adapun kenaikan titik didih disebut perbedaan titik didih larutan dengan titik didih pelarut murni. Kenaikan titik didih dilambangkan dengan ΔTb.
Berikut rumus kenaikan titik didih.
ΔTb = Tb larutan – Tb pelarut
ΔTb = Tb – Tb°
Secara umum semakin banyak zat yang terlarut dalam larutan maka kenaikan titik didih akan semakin besar. Sehingga, persamaan untuk menentukan perubahan titik didih sebanding dengan hasil kali molalitas (m) dengan nilai Kb pelarut. Berikut rumusnya.
ΔTb = m x Kb
Keterangan:
Tb larutan (Tb) = Titik didih larutan (°C)
Tb pelarut (Tb°) = Titik didih pelarut (°C)
ΔTb = Kenaikan titik didih (°C)
m = Molalitas larutan (molal)
Kb = Tetapan kenaikan titik didih molal (°C/molal )
3. Penurunan titik beku (∆Tf)
Titik beku normal suatu zat adalah suhu ketika zat melelh atau membeku pada tekanan 1 atm.Titik beku pelarut murni akan menurun ketika suatu zat terlarut ditambahkan pada suatu pelarut murni.
Hal ini disebabkan oleh adanya molekul-molekul pelarut sulit berubah menjadi fase cair karena pergerakan partikel pelarut dihalangi oleh partikel terlarut.
Dengan demikian, larutan akan membeku pada suhu yang lebih rendah dibanding titik beku pelarut murni air. Penurunan titik beku (ΔTf) merupakan selisih titik beku pelarut (Tfo) dengan titik beku larutan (Tf).
ΔTf = Tf pelarut – Tf larutan
ΔTf = Tf° – Tf
Menurut hukum Backman dan Raoult menyatakan bahwa penurunan titik beku dan kenaikan titik didih berbanding langsung dengan molalitas yang terlarut di dalamnya. Berikut rumusnya.
ΔTf = m x Kf
Keterangan :
Tf larutan (Tb) = Titik beku larutan (°C)
Tf pelarut (Tb°) = Titik beku pelarut (°C)
ΔTf = Penurunan titik beku (°C)
m = Molalitas larutan (molal)
Kf = Tetapan penurunan titik beku molal (°C/molal )
4. Tekanan osmotik (π)
Tekanan osmosis adalah perbedaan tekanan hidrostatis maksimum antara suatu larutan dengan pelarutnya. Sedangkan osmosis itu sendiri adalah perembesan molekul pelarut dari pelarut ke dalam larutan, atau dari larutan lebih encer ke pekat, melalui selaput semipermeabel.
Peristiwa osmosis terjadi saat molekul pelarut berpindah ke molekul larutan, bisa dilihat melalui gambar berikut.
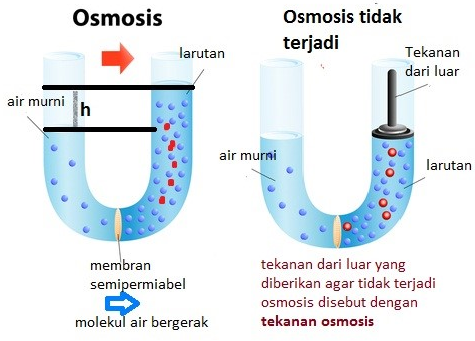
Hal tersebut ditandai dengan berhentinya perubahan volume larutan. Adapun tekanan osmosis terjadi ketika terdapat perbedaan volume dua larutan pada kesetimbangan yang menghasilkan suatu tekanan. Tekanan osmosis juga dapat diartikan sebagai tekanan yang diberikan untuk mencegah terjadinya peristiwa osmosis.
Adapun menurut Van’t Hoff, tekanan osmotic merupakan larutan-larutan encer yang dapat dikalkulasikan dnegan rumus yang serupa dengan persamaan gas ideal berikut ini.
PV = nRT atau П V = nRT
П = MRT
Keterangan :
П = Tekanan osmosis (atm)
M = Molaritas (mol/L)
R = Tetapan gas (0,082 atm L/mol K)
T = Suhu (K)
n= Mol terlarut (mol)
V = Volume larutan (L atau mL)
Baca : Perangkat Ajar Materi Kimia Kelas 10 SMA Kurikulum Merdeka
Demikian pengertian sifat koligatif larutan dan klasifikasinya. Semoga bermanfaat



