pH Larutan Asam Basa, Pengertian, Rumus, Soal dan Pembahasannya
Gurubagi.com. pH (Power of Hidrogen) berasal dari kata bahawa Jerman “potenz,” yang berarti “pangkat” dan dikombinasikan dengan H (unsur hidrogen). Dengan demikian pH adalah singkatan dari “pangkat hidrogen.”pH Asam Basa,
Pengertian pH adalah adalah skala derajat keasaman yang digunakan untuk menyatakan tingkat keasaman atau kebasaan suatu larutan. Skala dari pH terdiri dari angka 1 hingga 14.
Air murni bersifat netral, ditetapkan memiliki pH 7,0, pada suhu 25 °C Larutan dengan pH kurang daripada tujuh disebut bersifat asam, dan larutan dengan pH lebih dari tujuh dikatakan bersifat basa atau alkali.
Asam ada yang berbahaya karena bersifat racun, akan tetapi ada pula yang sangat diperlukan oleh tubuh kita . senyawa asam banyak dijumpai pada kehidupan sehari-hari.
1. Kekuatan asam basa
Berdasarkan banyaknya ion yang ionisasi asam dan basa, kekuatan asam dan basa dikelompokan menjadi asam kuat, asam lemah, basa lemah.
Dalam kesetimbangan ionisasi penyusunan reaksi : H2O ↔ [H+] + [OH–]
Sehingga air disebut elektrolit. Tetapan kesetimbangannya disebut tertapan kesetimbangan (Kw)
Kw =[H+] [OH–] = [10-14]
Oleh karena [H+] OH-] = 10-14, maka [H+] [10+7] dan [OH–] = 10-7. Potensi hidrogen (pH) menyatakan konsentrasi ion H+ , sedangkan dalam larutan dan pOH menyatakan konsentrasi OH–dalam larutan.
Baca :
- Konsep Asam Basa : Pengertian, Perkembangan, dan Contohnya
- Indikator Asam Basa, Pengertian, Jenis-jenis, Soal, dan Pembahasannya
Pada suhu kamar besarnya pKw = 14. Untuklarutan netral , pH = pOH=7 sehingga larutan yang bersifat asam pH < 7 dan larutan basa pH > 7. Semakin kecil pH, konsentrasi ion H+ semakin besar dan asam semakin kuat, begitu pula sebaliknya.
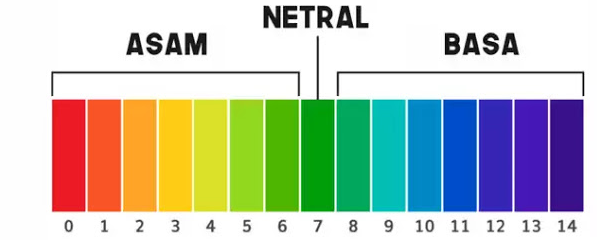
Jadi pH paling tinggi untuk asam adalah 7. Basa semakin kuat, konsentrsasi ion OH– semakin banyk, berate pOH semakin kecil dan pH semakin besar. Sebaliknya, semakian kecil pH, konsentrasi ion OH– semakin kecil dan pOH semakin besar.
Dapat disimpulkan sebagai berikut.
Larutan bersifat netral jika [H+] = [OH–] atau pH = pOH = 7
Larutan bersifat asam jika [H+] > [OH–] atau pH <7
Larutan bersifat basa jika [H+] < [OH–] atau pH >7
Larutan asam dan basa merupakan elektrolit, artinya dapat menghantarkan arus listik. Daya hantar ini berggantung pada konsetrasi ion-ionnya yang diukur dengan derajat ionisasi (α)
Besarnya α dirumuskan dengan :
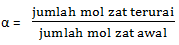
Harga α antara 0 sampai 1. Jika α = 1, berarti larutan terionisasi sempurna. Jika 1 < α < 0, larutan terioniasasi sebagian.
Larutan yang mengalami ionisasi sempurna berasal dari asam kuat dan basa kuat yang merupakan reaksi berkesudahan.
Contoh reaksi ionisasi asam basa kuat :
Asam kuat : HCl → H+ + Cl–
Basa kuat : NaOH → Na+ + OH–
Adapun ionisasi tidak semourna terjadi pada asam lemah dan basa lemah yang merupakan reaksi kesetimbangan.
Contoh reaksi ionisasi asam lemah dan basa lemah.
Asam lemah : CH3COOH ↔ H+ + CH3COO–
Basa lemah : NH4OH
Kekuatan asam basa menyatakan banyaknya konsentrasi H+ atau OH– dalam larutan dan dapat dihitung sebagai berikut.
a. Asam Kuat
Asam kuat mempunyai derajat ionisasi (α) = 1. Konsentrasi [H+] dicari dengan rumus sebagai berikut.
[H+] = x. Ma
Keterangan :
x = banyaknya ion H+ yang diikat ( valensi asam)
Ma = molaritas asam
b. Basa kuat
Mempunyai derajat ionisai (α) = 1. Konsentrasi [OH–] dicari dengan rumus sebagai berikut
[OH–] = Mb . x
Keterangan :
X = banyaknya ion OH– yang diikat (valensi basa)
Mb = konsentrasi basa
c. Asam lemah
Asam lemah terjadi karena terionisai tidak sempurna dengan derajat ionisasi 0 < α < 1
Contoh reaksi ionisasi asam lemah : CH3COOH ↔ H+ + CH4COO–
Secara umum reaksi ionisai asam lemah dituliskan sebagai berikut :
HA ↔ H+ + A–
Tetapan kesetimbangannya adalah :

Semakin kuat keasaman suatu larutan, maka harga Ka semakin besar. Hubungan antara konsentrasi H+ , konsentrasi asam (Ma) dan Ka dituliskan sebagai berikut.
[H+] = √Ka . Ma atau H+ = α.Ma
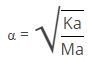
atau
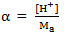
Keterangan :
Ka = tetapan kesetimbangan
Ma = konsentrasi asam
α = Derajat disosiasi
d. Basa lemah
Pada senyawa basa kekuatannya bergantung pada kelarutannya dalam air. semakin mudah larut, maka kekuatan basa akan semakin besar. Reaksi ionisasi basa lemah juga merupakan reaksi kesetimbangan.
Contoh: NaOH ↔ Na+ + OH–
Secara umu reaksi ionisasi basa lemah dapat dituliskan sebabagai berikut:
LOH ↔ L+ + OH–
Tetapan kesetimbanganya adalah :
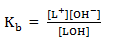
Konsentrasi ion OH– dapat diperoleh dengan rumus berikut ini.
![]()
atau
OH– = α . Mb

atau
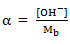
Keterangan :
Kb = tetapan kesetimbangan basa
Mb = konsentrasi basa
α = derajat disosiasi
2. Perhitungan pH larutabn Asam basa
a, pH larutan asam
pH = – log [H+]
b. pH larutan basa
pOH = -log [OH–]
pH = pKw – pOH = 14 – pOH
Latihan Soal dan Pembahasan
Soal nomor 1
Asam kuat HA sebanyak 0,01 mol dilarutkan dalam air hingga volume larutan menjadi 500 ml. Berapakah [H+] larutan tersebut ?
Pembahasan:
Diketahui
Volume 500 ml → 0,5 L
mol larutan = 0,01
Valensi asam HA = 1
Konsentrasi Ma = mol/volume = 0,01/0,5 = 0,02 M
Maka [H+] = x . Ma
= 1 . 0,02
= 0,02 M
Soal nomor 2
Sebanyak 8 gram NaOH (Mr = 40) dilarutkan dalam air hingga volumr larutan menjadi 1 liter. Tentukan konsentrasi ion OH– dalam larutan tersebut!
Pembahasan :
Diketahui
Massa NaOH = 8 gram
Volume larutan = 1 Liter
Mr NaOH =40
Valensi ion OH = 1
Karena pada data soal diatas tidak diketahui konsentrasi NaOH, maka harus cari ter,ebnih dahulu melalui rumus mol
mol = gram/Mr = 8/40 = 0,2 mol
M = mol/volume = 0,2 / 1
maka nilain konsentrasi nya = M = 1 mol/L
Untuk menentukan [OH–]menggunakan rumus [OH–] = Mb . x
[OH–] = 0,2 . 1
[OH–] = 0,2
Soal nomor 3
Hitungla pH dari larutan 100 ml H2SO4 0,02 M!
Pembahasan:
H2SO4 merupakan asam kuat yang memiliki bervalensi asam 2, maka
[H+] = X . Ma
= 2 x 0,02
= 4 x 10-2
Menghitung pH asam dengn rumus : pH = – log [H+]
pH = -log 4 X 10-2
pH = 2-log 4
Soal nomor 4.
Hitunglah pH larutan berikut !
a. NH3 0,1M (Kb =10-5 )
b. HF 0,1 M (Ka = 8,1 .10-4)
Pembahasan:
a. Menentukan pH basa lemah, mencari konsentrasi OH– terlebih dahulu dengan rumus :
![]()
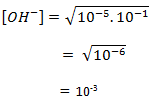
pOH= 3 – log 1
pOH = 3
pH = 14 – 3
pH = 11, sehingga dapat diketahu pH larutan tersebut adalah 11.
b. Menentukan pH asam lemah, mencari konsentrasi H+ terlebih dahulu dengan rumus :
[H+] = √Ka . Ma
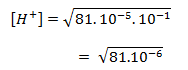
pH= 9. 10–3
pH= 3 – log 9
Demikian materi pH Larutan Asam Basa, Pengertian, Rumus, Soal dan Pembahasannya. Semoga bermanfaat.

