Latihan Soal Titrasi Asam Basa Kelas 11 SMA MA dan Kunci Jawabannya
Gurubagi.com. Berikut ini kami bagikan latihan soal Kimia materi titrasi asam basa kelas 11 SMA dan kunci jawabannya.
Titrasi asam basa merupakan teknik analisisi untuk menentukan konsentrasi larutan asam atau basa. Reaksi yang terjadi merupakan reaksi asam basa (netralisasi).
Larutan yang konsentrasinya sudah diketahui disebut larutan baku. Di dalam titrasi terdapat istilah titik ekuivalen dan titik akhir titrasi.
Titik ekivalen adalah titik ketika asam dan basa tepat habis bereaksi disertai denga perubahan warna indikatornya. Sedangkan titik akhir titrasi adalah saat terjadinya perubagan warna indikator.
Contoh soal Kimia titrasi asam basa kelas 11 SMA dan kunci jawabannya ini untuk membantu belajar peserta didik dalam memahami materi Kimia tentang titrasi asam basa.
Bentuk latihan soal kimia materi titrasi asam basa ini adalah Pilihan Ganda dengan lima alternatif jawaban dan sudah tersedia kunci jawabannya yang dapat di unduh dengan mudah
Soal nomor 1
NH4OH ditambah tiga tetes metal merah, kemudian dititrasi dengan larutan asam klorida. Persamaan reaksi yang terjadi sebagagai berikut :
NH4OH + HCl ↔ NH4Cl + H2O
Berdasarkan pernyataan tersebut, zat yang berfungsi sebagai titrat adalah ….
A. Air
B. Metal jingga
C. Asam klorida
D. Amonium klorida
E. Amonium hidroksida
Soal nomor 2
Penggunaan indikator fenolftalein dalam titrasi basa lemah dengan asam kuat tidak sesuai karena ….
A. pH larutan semakin besar
B. keasaman larutan semakin bertambah
C. trayek fenolftalein berada dibawah titik ekuivalen
D. Terjadi ekuivalen di bawah fenolftalein
E. Fenolftalein tidak dapat menunjukan perubahan warna
Soal nomor 3
Pada akhir titrasi antara larutan asam asetat dengan larutan kalium hidroksida dapat diketahui dengan perubahan warna indikator. Indikator yang sesuai adalah ….
A. Timol biru
B. Fenolftalein
C. Metal merah
D. Kresol ungu
E. Bromtimol biru
Soal nomor 4
Sebanyak 2 gram cuplikan NaOH dilarutkan dalam 250 ml air, kemudian 20 mL dari larutan ini dititrasi dengan HCl 0,1M, diperoleh data sebagai berikut.
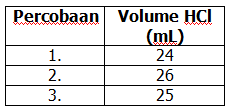
Maka kadar NaOH dalam cuplikan tersebut adalah ….(Mr NaOH = 40)
A. 20 %
B. 25%
C. 40%
D. 62,5 %
E. 75 %
Soal nomor 5
Sebanyak 40 mL larutan asam sulfat 0,25 M dititrasi dengan suatu basa bervalensi satu, ternyata dibutuhkan 57 mL basa. Maka kemolaran larutan basa yang digunakan tersebut adalah ….
A. 0,035 M
B. 0,05 M
C. 0,07 M
D. 0,35 M
E. 0,5 M
Soal nomor 6.
Konsentrasi dari larutan asam asetat CH3COOH jika untuk titrasi 25 mL larutan CH3COOH tersebut diperlukan 15 mL larutan NaOH 0,05 M agar mencapai titik ekuivalen, adalah ….
A. 0,01 M
B. 0,02 M
C. 0,03 M
D. 0,04 M
E. 0,05 M
Soal nomor 7
Sebanyak 50 mL sampel larutan NH3 yang konsentrasinya tidak diketahui dititrasi dengan larutan HCl 0,1 M, pH larutan yang dihasilkan diukur menggunakan pH-meter. Berikut disajikan grafik yang menggambarkan fungsi pH terhadap volume titran selama titrasi
Gambar
Pada titik X,spesi kimia yang memiliki konsentrasi terbesar adalah ….
A. NH4Cl
B. NH4+
C. OH–
D. Cl–
E. H3O+
Soal nomor 8
Sebanyak 20 mL asam sulfat dititrasi dengan larutan NaOH 0,1 M. Bila ternyata diperlukan 30 mL larutan NaOH, kemolaran asam sulfat tersebut adalah ….
A. 0,075 M
B. 0,1 M
C. 0,2 M
D. 0,3 M
E. 0,5 M
Soal nomor 9
Larutan CH3COOH sebanyak 20 mL dititrasi dengan Ba(OH)2 0,1 M dengan data sebagai berikut.
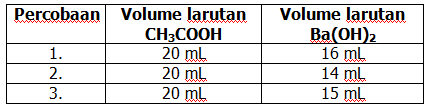
Berdasarkan data tersebut konsentrasi larutan CH3COOH adalah ….
A. 0,075 M
B. 0,1 M
C. 0,2 M
D. 0,3 M
E. 0,5 M
Soal nomor 10
Berikut hasil data titrasi larutan HCl dengan NaOH 0,1 M
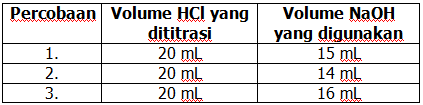
Berdasarkan data tersebut, konsentrasi larutan HCl adalah ….
A. 0,075 M
B. 0,1 M
C. 0,2 M
D. 0,3 M
E. 0,5 M
Soal nomor 11
Data titrasi 10 mL larutan NaOH 0,1 M dengan larutan H2SO4 sebagai berikut
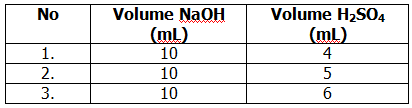
Massa H2SO4 yang bereaksi pada titrasi tersebut adalah ….(Mr H2SO4 = 98)
A. 0,049 gram
B. 0,059 gram
C. 0,96 gram
D. 1,29 gram
E. 9,8 gram
Soal nomor 12
Perhatikan sebuah kurva titrasi asam basa hasil percobaan untuk menentukan konsentrasi larutan NaOH 20 mL berikut ini!
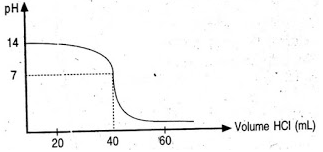
Jika asam yang digunakan untuk titrasi adalah HCl 0,1 M, maka konsentrasi larutan NaOH yang dititrasi sebesar ….
A. 0,2 M
B. 0,3 M
C. 0,4 M
D. 0,5 M
E. 0,6 M
Soal nomor 13
Berikut kurva perubahan harga pH pada titrasi :
CH3COOH (aq) + NaOH(aq) → CH3COONa(aq) + H2O(l)
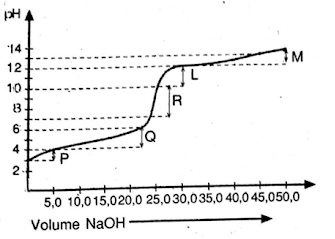
Dari kurva diatas, daerah kurva yang merupakan larutan penyangga adalah ….
A. M
B. Q
C. R
D. L
E. P
Soal nomor 14
Perhatikan grafik titrasi asam basa berikut!
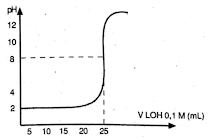
Jika volume larutan asam yang dititrasi sebanyak 20 mL. Konsentrasi larutan asam HX tersebut adalah ….
A. 0,05 M
B. 0,125 M
C. 0,32 M
D. 1,25 M
E. 1,50 M
Soal nomor 15
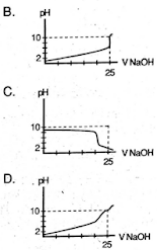
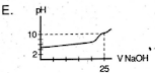
Seorang siswa melakukan titrasi asam basa, dengan menggunakan 25 mL larutan CH3COOH 0,1M dengan larutan NaOH 0,1 M. Maka perubabahan volume larutan NaOH yang ditambahkan menyebabkan perubahan grafik seperti berikut ….
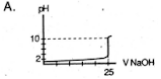
Kunci jawaban soal Kimia materi Titrasi asam basa di atas dapat di unduh di sini.
