Kelarutan : Faktor-faktor yang Mempengaruhi dan Hubungannya dengan Ksp
Gurubagi.com. Faktor-faktor yang mempengaruhi kelarutan suatu zat sebenarnya sering kita temukan dalam kegiatan kehidupan sehari-hari.
Istilah kelarutan dapat kita temukan dalam kehidupan sehari-hari. Pada saat kita mengonsumsi obat misalkan, biasanya kita akan melarutkan serbuk obat dalam air.
Dengan demikian, berarti kita sudah membuat suatu larutan yaitu obat dengan air dan larutan tersebut akan terurai menjadi ion-ionnya.
Akan tetapi jika serbuk obat ditambahkan lagi hingga tidak dapat larut dalam air, berarti larutan telah jenuh dan membentuk kestimbangan.
Berikut ini akan dibahas lebih jelas mengenai faktor-faktor yang mempengaruhi kelarutan, dan hubungannya kelarutan (s) dengan hsil kali kelarutan (Ksp)
Kelarutan dan Faktor-faktor yang Mempengaruhinya
Larutan terdiri atas zat yang dilarutkan (solut) dan pelarut (solven). Kelarutan adalah nilai konsentrasi maksimum yang dapat yang dapat dicapai oleh suatu zat dalam larutan.
jadi kelarutan digunakan untuk untuk menyatakan jumlah maksimum zat yang dapat larut dalam larutan jenuh.
Berdasarkan pengertian kelarutan di atas, larutan dibedakan menjadi tiga, yaitu
- Larutan tidak jenuh, yaitu larutan yang masih dapat melarutkan zat terlarutnya pada suhu tertentu.
- Larutan jenuh, yaitu suatu larutan dengan jumlah zat terlarut (molekul atau ion) yang telah maksimum pasa suhu tertentu.
- Larutan lewat jenuh, yaitu suatu larutan denganh zat terlarut yang melebihi jumlah maksimum kelarutannya pada suhu tertentu.
Faktor-faktor yang Mempengaruhi Kelarutan
Besarnya kelarutan suatu zat dipengaruhi oleh bebrapa faktor. Berikut ini adalah faktor-faktor yang memepengaruhi kelarutan.
1. Jenis pelarut
Senyawa non polar tidak dapat larut dalam senyawa polar, begitu juga sebaliknya. Maka,dapat disimpulkan bahewa, dua zat tersebut bisa bercampur, jika keduannya memiliki jenis yang sama.
Contohnya adalah mencampurkan minyak dengan air. Minyak tidak akan bisa menyatu jika di campurkan dengan air, karena minyak merupakan senyawa non-polar, sedagkan air merupakan senyawa polar.
2. Suhu
Kelarutan suatu zat dipengaruhi oleh suhu. Semakin tunggi suatu larutan makajarak antar molekul zat padat menjadi semakin renggang.
Hal ini menyebabkan ikatan antara zat semakin mudah terlepas oleh gaya tarik molekul-molekul air, sehingga zat tersebut mudah larut.
Contohnya adalah pada saat kita melarutka gula ke lam air, gula akan mudah larut di dalam air panas, dibandingkan dilarutkan dalam air dingin.
3. Pengadukan
Dengan diaduk berarti tumbukan antar partikel-partikel gula dengan pelarut akan semakin cepat, sehingga gula akan lebih mudah larut dalam air.
4. pH
Faktor-faktor yang mempengaruhi kelarutan berikutnya yaitu pH. Kelarutan dari garam-garam yang berasal dari asam lemah bergantung pada larutannya.
Contoh asam oksalat, saat dilarutkan ke dalam air akan melepaskan ion H+dan ion C2O42-. Ion H+ dari air akan bergabung dengan ion oksalat C2O42- membentuk asam oksalat kembali H2C2O4 sehingga menambah kelarutan garamnya
Hasil Kali Kelarutan (Ksp)
Jika kalian melarutkan satu sendok garam dalam segelas air, pada awalnya garam akan larut dalam air. Akan tetapi jika garam yang kalian larutkan ditambah semakin banyak, garam tersebut tidak dapat larut lagi, karena larutan menjadi jenuh.
Baca :
- Pengaruh Ion Senama Pada Kelarutan, Contoh Soal, dan Pembahasannya
- Hubungan Ksp dan pH Larutan, Contoh Soal dan Pembahasannya
- Hubungan Ksp dan Reaksi Pengendapan, Beserta Contoh Soalnya
Larutan bersifat jenuh , jika jumlah zat yang ditambahkan melebihi batas maksimum kelarutan. Akibatny terkadi pengendapan larutan.
Jika suatu garam mengalami kondisi tepat jenuh, garam tersebut akan membentuk kesetimbangan. Terjadinya kesetimbangan dipengaruhi oleh zat padat yang tidak larut dan ion-ion zat terlarut. Jadi Ksp adalah nilai maksimum dari ion-ion yang berada dalam larutan.
Reaksi yang terjadi adalah sebagai berikut:
![]()
Berdasarkan aturan penulisan rumus kesetimbangan, hanya zat dalam bentuk larutan (aq) dan gas (s) yang dituliskan di dalam rumus, sehingga diperoleh:
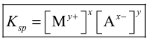
Hubungan Kelarutan dan Hasil Kali Kelarutan (Ksp)
Kelarutan digunakan nntuk menyatakan jumlah maksimum zat yang dapat larut dalam larutan jenuh. Karena kelarutan (s) dan hasil kelarutan (Kp) dihitung pada larutan jenuh yang sama, maka antara s dan Kp terdapat hubungan yang erat.
Perhatikan contoh berikut!
Suatu senyawa Ag2CrO4 dilarutkan dalam air, maka untuk menghitung besar hasil kali kelarutannya, terlebih dahulu harus menentukan bear kelarutan tiap-tiap zat.
Misalkan dilambangkan dengan huruf s (mol/L), maka Ksp nya adalah bsebagai beriku.
Ag2CrO4(s) ↔ 2Ag+(aq) + CrO42- (aq)
s 2s s
Ksp = [2s]2 [s]
Ksp = 4s3
Secara umum , jika larutan jenuh dari senyawa ion AxBy memiliki kelarutan M, maka larutan tersebut akan terionisasi dalam air.
Perhatikan reaksi kesetimbangan berikut.
AxBy(s) ↔ xAy+(aq) + yBx- (aq)
Jika harga kelarutan s dari senyawa AxBy sebesar s M, maka dapat ditentukan besar konsentrasi ion Ay+ dan Bx- sebagai berikut.
AxBy(s) ↔ xAy+(aq) + yBx- (aq)
s M x s M y s M
Dari persamaan di atas diperoleh harga Ksp, yaitu sebagai berikut.
Ksp = [Ay+ ]x [Bx- ]y
= (Xsyx (Ys)y
= Xx . Y y. (s) x + y
Jadi untuk reaksi kesetimbangan AxBy(s) ↔ xAy+(aq) + yBx- (aq) diperoleh :
1. Hasil kali kelarutan senyawa AxBy
Ksp = [Ay+ ]x [Bx- ]y
2. Kelarutan senyawa AxBy
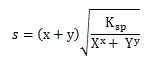
keterangan :
s = kelarutan dalam M atau mol/L
Contoh soal
Soal nomor 1
Tentukan rumus hasil kali kelarutan (KSP) dari
a. Ag2CrO4
b. Ca(OH)2 dalam air adalah s mol L-
Pembahasan :
Menggunakan persamaan berikut : Ksp = [Ay+ ]x [Bx- ]y
a. Ag2CrO4
Ksp = [Ag+ ]2 [CrO4-2 ]1
b. Ca(OH)2
Reaksi ionisasi Ca(OH)2 adalah ; Ca(OH)2((s) ↔ Ca2+(aq) + 2OH– (aq)
Ca(OH)2 ↔ [Ca2+] + [2OH–]2
s mol/L s mol/L 2s mol/L
Ksp Ca(OH)2 = [Ca+2] [2OH–]2
Ksp = [s] [2s]2
Ksp = 4s3
Soal nomor 2
Jika hasil kali kelarutan dari Ca(OH)2 dalam air adalalah 4.10-6 maka tentukan kelarutan dari Ca(OH)2 tersebut!
Pembahsan :
Ca(OH)2 ↔ [Ca2+] + [2OH–]2
s mol/L s mol/L 2s mol/L
Ksp Ca(OH)2 = [Ca+2] [2OH–]2
Ksp = [s] [2s]2
Ksp = 4s3
4.10-6 = 4s3
s3 =4 .10-6 /4
s3 = 10-6
s = 10-2 mol/L
Demikian materi faktor-faktor yang mempengaruhi kelarutan dan hubungannya dengan Ksp. Semoga bermanfaat.


