Tata Nama Senyawa Kovalen, Contoh Soal, dan Pembahasannya
Gurubagi.com. Senyawa kovalen adalah senyawa kimia yang terbentuk dari dua unsur atau lebih unsur, karena pemakaian bersama pasangan elektron.
Senyawa kovalen juga dapat didefinisikan sebagai senyawa yang terbentuk dari dua atau lebih unsur non logam, sehingga membentuk ikatan kovalen. Ikatan kovalen melibatkan penggunaan pasangan elektron secara bersama-sama.
Perbedaan mendasar senyawa kovalen dengan senyawa ion adalah senyawa ion selalu tersusun atas unsur logam dan nonlogam, sedangkan senyawa kovalen tersusun dari sesama unsur nonlogam saja.
Berbeda dengan senyawa ion, senyawa kovalen tidak memiliki elektron yang bebas bergerak. Oleh karena itu, senyawa kovalen tidak dapat menghantarkan arus listrik,
Salah satu contoh senyawa kovalen adalag metana. Metana adalah senyawa yang hanya mengandung unsur karbon dan hidrogen. Karena pembakarannya yang sangat mudah, sehingga metana sering dimanfaatkan untuk bahan bakar.
Baca :
- Tata Nama Senyawa Anorganik dan Organik Serta Contoh Soalnya
- Tata Nama Senyawa Ion, Contoh Soal, dan Pembahasannya
Penulisan Senyawa Kovalen
Penulisan senyawa kovalen yang tersusun atas unsur nonlogam dan nonlogam mengikuti aturan sebagai berikut.
1. Penulisan senyawa kovalen sesuai dengan aturan IUPAC, yaitu dengan menuliskan jumlah unsur pertama, nama unsur pertama, jumlah unsur kedua, dan nama unsur kedua ikuti dengan akhiran –ida.
2. Unsur yang elektronegativitasnya lebih kecil (bilangan oksidasi positif) tulis pada bagian depan.
3. Unsur yang elektronegativitasnya lebih besar (bilangan oksidasi negatif) tulis pada bagian belakang.
Contoh :
Senyawa air, yaitu H2O, bukan OH2 karena elektronegativitas H (2,1) < O (3,5), sehingga meletakan unsur H pada bagian depan. Contoh lainnya adalah CO, CO2, dan CCl4.
4. Khusus untuk senyawa yang tersusun antara C dan H, menuliskan unsur C pada bagian depan dan H belakang, meskipun elektronegatifitasH (2,1) < C (2,5).
Contoh :
Metana ditulis CH4 bukan H4C. Senyawa yang terdiri dari N dan H, penulisan N pada bagian depan, sedangkan H belakang, meskipun elektronegativitas H (2,1) < N (3,0).
Contoh : amonia ditulis NH3, bukan H3N.
Untuk lebih jelasnya, dalam penulisan unsur-unsur senyawa kovalen mengikuti urutan berikut, kemudian tambahkan akhiran-ida.
B – Si – C – S – As – P – N – H – S – I – Br – Cl – O – F
Contoh :
Nama Hidrogen Fluorida ditulis HF, bukan FH, karena H berada pada urutan lebih awal dari F.
5. Penamaan senyawa dengan jumlah atom penyusunnya mengikuti aturan dalam bahasa Romawi sebagai berikut.
1 = mono
2 = di
3 = tri
4 = tetra
5 = penta
6 = heksa
7 = hepta
8 = okta
9 = nona
10. = deka
Contoh nama senyawa kovalen.
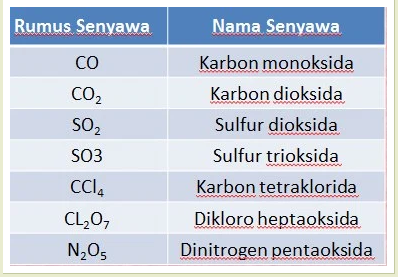
Contoh Soal dan Pembahasan Tata Nama Senyawa Kovalen
1. Berilah nama pada senyawa-senyawa berikut ini!
a. SO2
b. CO3
c. CCl4
d. N2O4
Pembahasan :
a. SO2 = senyawa ini tersusun atas satu atom belerang dan dua atom oksigen, sehingga namanya menjadi belerang dioksida (tidak perlu mnyebutlan indeks angka satu unsur pertama).
b. CO3= karbon trioksida.
c. CCl4= karbon tetraklorida.
d. N2O4= dinitrogen tetraklorida.
2. Tuliskan rumus kimia dari nama-nama senyawa di bawah ini!
a. Boron triklorida.
b. Belerang heksafluorida.
c. Dinitrogen pentaoksida.
d. Karbon monoksida.
Pembahasan :
a. Boron triklorida = tersusun dari satu atom boron dan tiga atom klor, sehingga rumus kimia senyawanya adalah BCl3.
b. Belerang heksafluorida = SF6
c. Dinitrogen pentaoksida = N2O5
d. Karbon monoksida = CO
Demikian sekilas materi tentang tata nama senyawa kovalen beserta contoh soal. Semoga bermanfaat.



