Atom Stabil dan Tidak Stabil : Pengertian dan Contohnya
Gurubagi.com. Kita akan mempelajari kestabilan unsur gas mulia dan cara atom-atom lain mencapai kestabilan seperti atom-atom unsur gas mulia,
Unsur-unsur gas mulia atau unsur golongan VIIIA merupakan sala satu keompok unsur yang sudah stabil. Unsur alami lainnya cenderung tidak stabil jika berdiri sendiri.
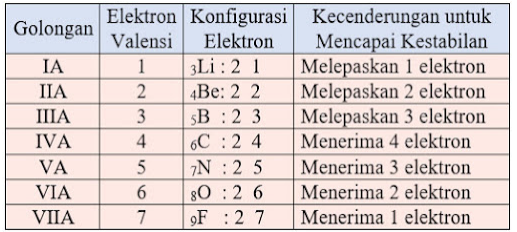
Hal ini terjadi diakibatkan kulit terluar pada atom unsur gas mulia telah terisi penuh. Maka dari itu konfigurasi elektron gas mulia menjadi tolak ukur kestabilan, maka kita perlu meninjaunya terlebih dahulu
Setiap atom akan berusaha untuk mencapai kestabilan seperti unsur gas mulia, Sehingga atom akan berikatan dengan atom lain dalam rangka mencapai kestabilan.
Kestabilan unsur
Konfgurasi unsur gas mulia dapat dilihat pada tabel di bawah ini.
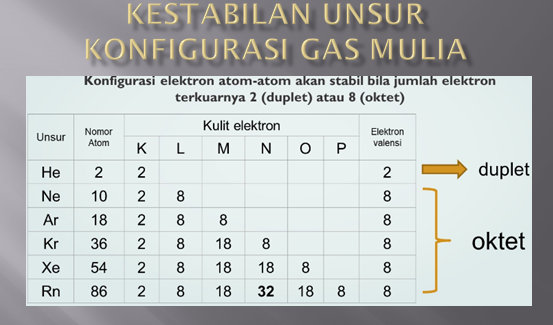
Kestabilan gas mulia inilah yang ingin dicapai oleh unsur-unsur lainnya, hingga mereka cenderung bereaksi dan membentuk ikatan kimia, menghasilkan suatu molekul atau senyawa yang stabil.
Cara atom mencapai kestabilan
Cara untuk mencapai kestabilan, atom netral akan berusaha untuk memiliki konfigurasi elektron gas mulia yang terdekat dengannya.
Konfigurasi gas mulia dapat dicapai oleh suatu atom dengan berbagai cara sebagai berikut:
1. Melepaskan Elektron
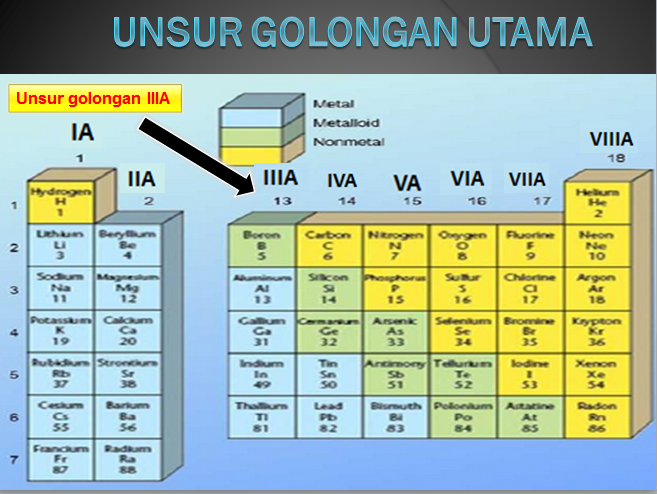
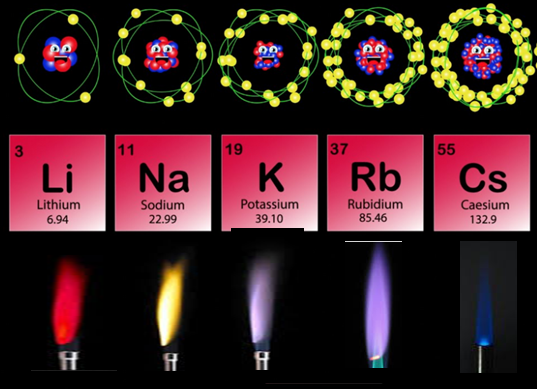
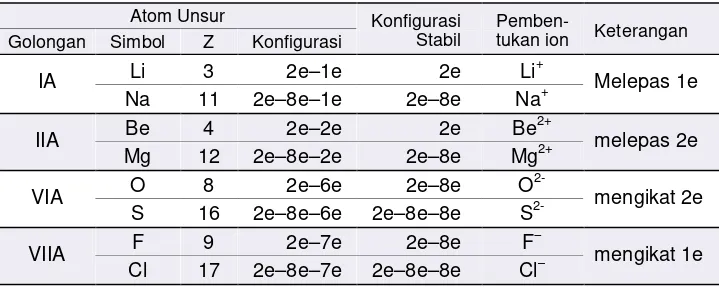
Atom-atom unsur yang memiliki elektron valensi selain gas mulia, misalnya unsur-unsur golongan IA, IIA, dan IIIA cenderung mengikuti kaidah oktet dengan cara melepaskan elektron untuk membentuk ion positif.
Baca : Materi Kimia Larutan Elektrolit dan Non Elektrolit Kelas 10 SMA MA SMK
Unsur-unsur ini merupakan unsur-unsur logam (unsur elektropositif). Atom-atom yang melepaskan elektron akan berubah menjadi ion positif atau kation. Contoh Soal:
2. Menangkap Elektron
Atom-atom unsur yang menangkap elekton adalah atom-atom unsur yang memiliki elektron valensi dalam jumlah banyak dalam pembentukan suatu senyawa.
Seperti unsur-unsur golongan IV, VA, VIA, dan VIIA memiliki kecenderungan mengikuti kaidah-kaidah oktet dengan cara menerima elektron untuk membentuk ion negatif.
Unsur-unsur yang cenderung membentuk ion negatif disebut elektronegatif. Unsur-unsur ini merupakan unsur-unsur non logam (unsur elektronegatif).
Oleh karena itu, semua unsur-unsur dalam tabel periodik akan membentuk kestabilan dengan mengikuti konfigurasi gas mulia.
Contoh unsur mencapai kestabilan
Unsur Ca dalam sistem periodik terletak pada golongan IIA periode 4 dengan nomor atom 20. Konfigurasi elektron Ca : 1s2 2s2 2p6 3s2 3p6 4s2.
Unsur Ca akan mencapai kestabilan, unsur Ca akan mengikuti konfigurasi gas mulia Ar (nomor atom 18),
sehingga 2 elektron pada kulit keempat (4s) akan dilepaskan. Jadi, unsur Ca akan stabil dengan cara berubah menjadi ion Ca²+.
Demikian Pengertian atom stabil dan tidak stabil dan contohnya. semoga bermanfaat.