Contoh Soal Sel Elektrolisis dan Hukum Faraday Kimia Kelas 12 SMA MA
Gurubagi.com. Berikut ini kami bagikan contoh soal sel elektrolisis dan hukum Faraday untuk kimia kelas 12 SMA MA dan kunci jawabannya.
Contoh soal sel elektrolisis dan hukum Faraday kimia kelas 12 SMA MA ini untuk membantu belajar peserta didik dalam memahami materi sel elektrolisis dan hukum Faraday.
Bentuk contoh soal sel elektrolisis dan hukum Faraday kimia kelas 12 SMA/MA ini adalah Pilihan Ganda dengan lima alternatif jawaban dan sudah tersedia kunci jawabannya yang dapat di unduh dengan mudah.

Soal nomor 1
Elektrolisis adalah proses perubahan energi ….
A. kimia menjadi listrik
B. listrik menjadi kimia dalam reaksi redoks
C. listrik menjadi oksidasi
D. listrik menjadi reduksi
E. lisrik menjadi fisika
Soal nomor 2
Di dalam elektrolisis digunakan 2 buah elektroda yang bermuatan. Pernyataan ini yang benar berikut ini adalah ….
A. katoda bermuatan positif dan anoda bermuatan netral
B. katoda bermuatan negatif dan anoda bermuatan netral
C. katoda bermuatan negatif dan anoda bermuatan positif
D. katoda bermuatan netral dan anoda bermuatan negatif
E. katoda dan anoda tidak bermuatan
Soal nomor 3
Perhatikan gambar di bawah ini!
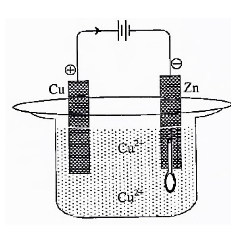
Sendok logam yang terbuat dari zink akan disepuh dengan logam tembaga. Reaksi yang terjadi di katoda adalah ….
A. Cu2+(aq) + Zn(s) → Cu(s) + Zn2+(aq)
B. Zn(s) → Zn2+(aq) + 2e
C. Zn2+(aq) + 2e → Zn(s)
D. Cu(s) → Cu2+(aq) + 2e
E. Cu2+(aq) + 2e → Cu(s)
Soal nomor 4
Perhatikan peristiwa elektrolisis berikut!
(1) Lelehan NaBr dengan elektrode platina
(2) Larutan K2SO4 dengan elektrode karbon
(3) Lelehan HCl dengan elektrode platina
(4) Larutan CuSO4 dengan elektrode karbon
Pasangan reaksi di anoda yang menghasilkan gas O2 terjadi pada nomor :
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Soal nomor 5
Perhatikan sel elektrolisis berikut ini!
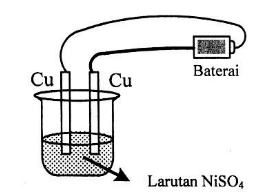
Reaksi yang terjadi di anoda adalah ….
A. Ni2+(aq) + 2e → Ni(s)
B. Cu(s) → Cu2+(aq) + 2e
C. 2H2O(l) → 4H+(aq) + O2(g) + 4e
D. SO2- (aq) + 4 H+(aq) + 2e → 2H2O(1) + SO2(g)
E. Ni(s) → Ni2+(aq) + 2e
Soal nomor 6
Sebuah sendok disepuh dengan perak dalam larutan perak nitrat dengan kuat arus 10 ampere selama 15 menit. Banyaknya perak yang melapisi sendok tersebut adalah …. (Ar Ag = 108)
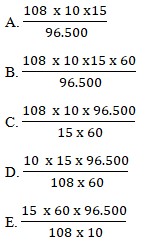
Soal nomor 7
Perhatkan gambar berikut!
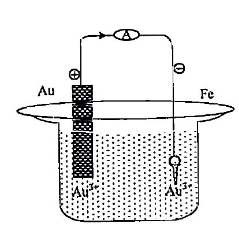
Berdasarkan gambar tersebut terdapat wacana jika kunci yang terbuat dari besi akan disepuh dengan logam emas menggunakan kuat arus 10 ampere selama 9650 detik. Pada reaksi penyepuhan kunci besi dengan logam emas diperlukan arus listrik 0,015 Faraday, massa logam emas yang melapisi kunci besi tersebut adalah …. (Ar Au = 197 g.mol-1)
A. 0,0985 gram
B. 0,2985 gram
C. 0,9850 gram
D. 2,9850 gram
E. 9,8600 gram .
Soal nomor 8
Arus listrik (faraday) yang diperlukan untuk mereduksi 60 gram ion kalsium menjadi logam kalsium adalah …. (Ar Ca = 40)
A. 1,0 Faraday
B. 1,5 Faraday
C. 2,0 Faraday
D. 3,0 Faraday
E. 4,0 Faraday
Baca : Latihan Soal Polimer Kimia Kelas 12 SMA MA Kurikulum 2013
Soal nomor 9
Pada elektrolisis larutan NaCl, reaksi pada akhir reaksi adalah ….
A. 2NaCl → Cl2 + 2 Na
B. NaCl → Na + Cl
C. NaCl + H2O → H2 + OH– + Cl2
D. 2NaCl + 2H2O → H2 + 2 OH- + Cl2
E. 2NaCl + H2O → H2 + OH– + 2 Cl–
Soal nomor 10
Larutan CuCl2 (Ar Cu=63,5) dielektrolisis menggunakan elektroda C dengan arus sebesar 5 ampere selama 30 menit. Logam Cu yang diendapkan di katode sebanyak ….
A. 1,48 gram
B. 2,96 gram
C. 5,92 gram
D. 29,6 gram
E. 59,2 gram
Soal nomor 11
Perhatikan reaksi redoks berikut!
aH2O (l) + bCl – (aq) + 2MnO4 – (aq) → cCl2 (g) + 2MnO2 (s) + dOH– (aq)
Setelah persamaan reaksi disetarakan maka harga a, b, c, dan d adalah ….
A. 8,6,4 dan 3
B. 6,8,3 dan 4
C. 6,4,3 dan 8
D. 4,3,6 dan 8
E. 4,6,3 dan 8
Soal nomor 12
Perhatikan gambar berikut!
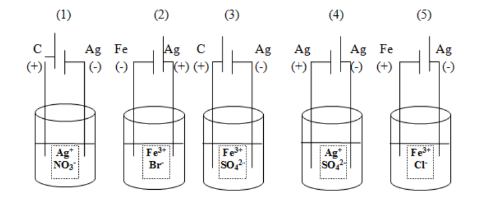
Sesuai gambar di atas, reaksi elektrolisis yang menghasilkan pH di bawah 7 adalah ….
A. (1) dan (2)
B. (2) dan (3)
C. (1) dan (3)
D. (2) dan (4)
E. (1) dan (5)
Soal nomor 13
Pada penyepuhan cincin tembaga dengan emas digunakan larutan AuCl3 (Ar Au = 197 g/mol). Pengrajin perhiasan menyepuh cincin tembaga dengan emas selama 9650 detik dengan arus 3 Ampere. Massa emas yang digunakan untuk melapisi cincin tembaga sebanyak … gram.
A. 197
B. 3,94
C. 7,88
D. 19,70
E. 39,40
Soal nomor 14
Toni ingin membuktikan pengaruh beberapa variabel terhadap korosi logam besi. Untuk itu Toni melakukan lima percobaan seperti gambar berikut.

Berdasarkan percaobaan di atas, yang menghasilkan karat paling cepat adalah ….
A. 1
B. 2
C. 3
D. 4
E. 5
Soal nomor 15
Perhatikan gambar berikut !
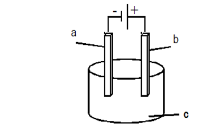
Pada sel elektrolisis di atas, terjadi reaksi berikut.
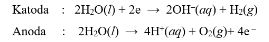
Zat yang mungkin pada a,b, dan c berturut-turut adalah ….
A. C, C, NaCl(l)
B. C, Fe, NaNO3(aq)
C. Pt,Pt, K2SO4(aq)
D. Pt,Fe, NaOH(l)
E. Fe,C, KOH(aq)
Soal nomor 16
Pencegahan korosi pada kaleng makanan dapat dilakukan dengan cara ….
A. perlindungan katodik
B. pelapisan timah
C. pelapisan krom
D. pengecatan
E. galvanisasi
Soal nomor 17
Pada elektrolisis leburan seng klorida menggunakan elektrode karbon dengan arus listrik sebesar 4 A selama 30 menit akan terbentuk … ( Ar Zn = 65 gmol-1, Cl= 35,5 gmol-1)
A. gas klorin di katode
B. gas hidrogen di anode
C. endapan seng di anode
D. gas klorin sebanyak 0,84 L
‘E. endapan seng sebanyak 1,21 gram
Soal nomor 18
Industri alumunium diperoleh dengan cara elektrolisis leburan Al2O3. Apabila parik beroperasi selama 8 jam per hari arus listrik yang digunakan sebesar 105 Ampere. Alumunium dalam ton yang dihasilkan selama 1 tahun adalah …. (Ar Al = 27)
A. 0,98
B. 9,8
C. 98
D. 980
E. 9800
Soal nomor 19
Ke dalam 2 sel larutan ZnSO4 dan larutan CuSO4 yang dihubungkan secara seri dialirkan arus listrik ternyata diendapkan 16,25 gram seng. Jika Ar Zn = 65 dan Ar Cu = 63,5 maka banyaknya tembaga yang mengendap adalah …. gram.
A. 7,94
B. 15,88
C. 23,82
D. 31,75
E. 39,69
Soal nomor 20
Di dalam elektrolisis larutan Cu(NO3)2 dengan elektroda inert, 1,27 gram Cu (Ar Cu 63,5) diendapkan, volume gas yang dihasilkan di anode pada 1 atm, 0 oC adalah …. L
A. 0,0224
B. 0,224
C. 2,24
D. 22,4
E. 224
Kunci Jawaban – Unduh
Demikian yang dapat kami bagikan mengani contoh soal sel elektrolisis dan Hukum Faraday kimia kelas 12 SMA MA. Semoga bermanfaat


Kak bisa gak jwb beserta caranya
Baik, nanti kami lengkapi dengan caranya. Terima kasih kunjugannya.