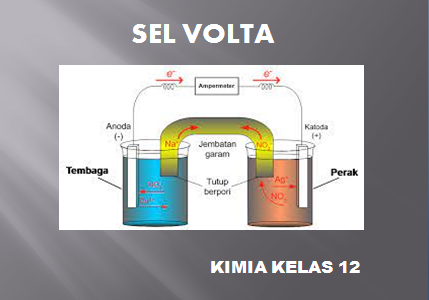
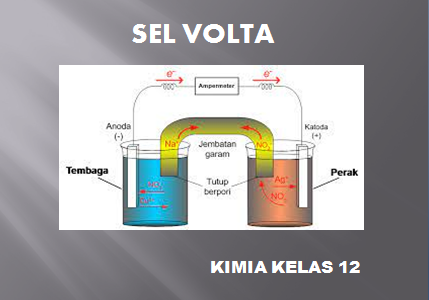
Contoh Soal Sel Volta Kimia Kelas 12 SMA MA Kurikulum 2013
Gurubagi.com. Berikut ini kami bagikan contoh soal sel volta untuk kimia kelas 12 SMA MA kurikulum 2013.
Contoh soal sel volta kimia kelas 12 SMA MA kurikulum 2013 ini untuk membantu belajar peserta didik dalam memahami materi sel volta.
Bentuk latihan soal sel volta kimia kelas 12 SMA/MA ini adalah Pilihan Ganda dengan lima alternatif jawaban dan sudah tersedia kunci jawabannya yang dapat di unduh dengan mudah.
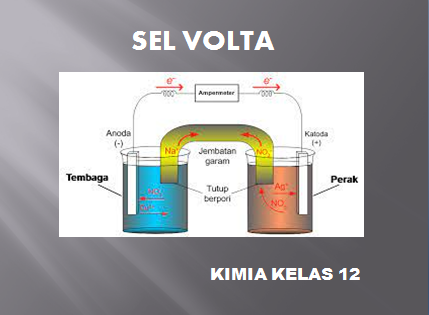
Soal nomor 1
Jika diketahui :
Zn2+/Zn Eo = – 0,76 Volt
Cu2+/Cu Eo = + 0,34 Volt
maka besarnya potensial sel (Eosel) volta tersebut adalah ….
A. -0,42 Volt
B. -1,10 Volt
C. +0,42 Volt
D. +1,10 Volt
E. +11,0 Volt
Soal nomor 2
Diketahui data potensial reduksi standar sebagai berikut.
Ca2+ + 2e → Ca Eo = -2,87 volt
Al3+ + 3e → Al Eo = -1,66 volt
Besarnya harga potensial sel pada reaksi : 3Ca + 2Al3+ → 3Ca2+ + 2Al adalah ….
A. -11,9 v
B. -4,53 v
C. +1,21 v
D. +5,26 v
E. +11,9 v
Soal nomor 3
Diketahui data potensial reduksi standar sebagai berikut.
Cd2+ + 2e → Cd Eo = -0,40V
Cr3+ + 3e → Cr Eo = -0,74V
Berdasarkan data tersebut, pernyataan berikut yang benar adalah ….
A. Cd adalah reduktor yang lebih kuat daripada Cr
B. jika kedua reaksi setengah sel tersebut dihubungkan, maka Cr3+ akan tereduksi menjadi Cr
C. pada anoda terjadi oksidasi Cd menjadi Cd2+
D. potensial sel elektrokimia yang terjadi adalah 0,34V
E. pada katoda terjadi reduksi Cr3+ menjadi Cr
Soal nomor 4
Apabila diketahui potensial reduksi berikut: E Sn2+ |Sn = – 0,14 V E Fe3+ |Fe = – 0,04 V, sehingga keduanya dapat bereaksi secara spontan, pernyataan paling tepat mengenai hal tersebut adalah ….
A. logam besi bertindak sebagai anoda
B. logam timah bertindak sebagai elektroda positif
C. potensial standar sel yang dihasilkan sebesar + 0,18 Volt
D. reaksi selnya adalah Fe3+ + Sn(s) → Fe(s) + Sn2+
E. notasi selnya adalah Fe| Fe || Sn |Sn
Soal nomor 5
Tulisan reaksi sel seimbang untuk skema sel di bawah ini, hitung potensial sel standar, dan catat apakah reaksi spontan dalam kondisi keadaan standar untu Cu(s) │ Cu2+(aq) ║ Au3+ (aq) │Au(s) adalah ….
A. 3Cu(s) + 2Au3+ (aq) ⟶3Cu+2(aq) + 2Au(s) +1.16V; spontan
B. 3Cu(s) + 2Au3+ (aq) ⟶3Cu2+ (aq) + 2Au(s) −1.16V; spontan
C. 3Cu2+ (aq) + 2Au(s) ⟶3Cu(s) + 2Au3+ (aq); −0.818V; non-spontan
D. 3Cu2+ (aq) + 2Au(s) ⟶3Cu(s) + 2Au3+ (aq0 +0.818V; spontan
E. 3Cu2+ (aq) + 2Au(s) ⟶3Cu(s) + 2Au3+ (aq); +1.50V; spontan
Soal nomor 6
Perhatikan reaksi berikut!
![]()
Potensial sel standar untuk reaksi diatas, dan catat apakah reaksi spontan dalam kondisi keadaan standar adalah ….
A. -2,629 V; Non-spontan
B. +2,115 V; Spontan
C. +2,269 V; Spontan
D. -2,115 V; Non-spontan
E.+2,115V ; Non-spontan
Soal nomor 7
Berikut ini beberapa metode pencegahan korosi besi.
1. Mengecat.
2. Melumuri oli.
3. Dibalut dengan plastik.
4. Perlindungan katoda.
5. Galvanisasi.
Metode yang paling tepat digunakan untuk melindungi pipa besi yang ada di dalam tanah adalah …
A. 1
B. 2
C. 3
D. 4
E. 5
Soal nomor 8
Perhatikan reaksi di bawah ini!
![]()
Nilai potensial sel standar untuk reaksi di atas, dan catat apakah reaksi spontan dalam kondisi keadaan standar adalah ….
A. -2,269 V; non-spontan
B. +2,269 V; spontan
C. -0,727; spontan
D. -0,727; non-spontan
E. +0,727 ; spontan
Soal nomor 9
Diketahui elektroda :
Eo= 0,79 volt
Eo= -2,34 volt.
maka notasi sel yang terbentuk adalah ….
A. Ag+ / Ag // Mg2+ / Mg
B. Mg2+ / Mg // Ag / Ag+
C. Ag / Ag+ // Mg / Mg2+
D. Mg / Mg2+ // Ag+ / Ag
E. Ag+ / Ag // Mg /Mg2+
Soal nomor 10
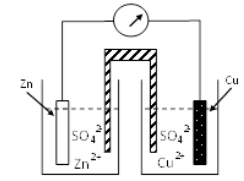
Perhatikan gambar sel volta berikut!
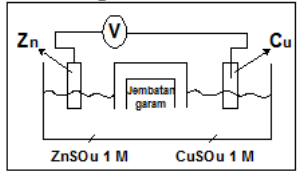
Jika diketahui :
Eo Zn2+ /Zn = -0,76 V
Eo Cu2+ /Cu = +0,34 V
Pernyataan berikut sesuai dengan gambar sel volta di atas, kecuali ….
A. elektron mengalir dari elektroda Zn ke elektroda Cu
B. logam Zn bertindak sebagai Anoda
C. potensial sel yang dihasilkan sebesar 1,10 Volt
D. pada katoda terjadi reduksi ion Cu2+
E. jembatan garam dapat diganti kawat penghantar
Soal nomor 11
Diketahui data potensial standar berikut.
Zn2+ + 2e → Zn Eo = -076 Volt
Cu2+ + 2e →Cu Eo = +076 Volt
Mg2+ + 2e → Mg Eo = -2,34 Volt
Cr3+ + 3e → Cr Eo = -0,74 Volt
Harga potensial sel yang paling besar terdapat pada ….
A. Zn /Zn2+ // Cu2+ / Cu
B. Cr /Cr3+ // Cu2+ / Cu
C. Zn /Zn2+ // Cr3+ / Cr
D. Mg /Mg2+ // Cu2+ / Cu
E. Mg /Mg2+ // Cr3+ / Cr
Soal nomor 12
Suatu sel volta ditulis dalam diagram sel sebagai berikut.
Cr(s)| Cr3+(aq) ∥ Cu2+ (aq)|Cu (s)
Persamaan reaksi dari notasi sel di atas adalah ….
A. Cu2+(aq) + Cr(s) → Cu(s) + Cr3+(aq)
B. Cu(s) + Cr3+ (aq) → Cu2+(aq) + Cr(s)
C. 3 Cu2+(aq) + 2Cr(s) → 3 Cu(s) + 2 Cr3+(aq)
D. Cu2+(aq) + Cr(s) → Cu(s) + Cr2+ (aq)
E. Cu(aq) + Cr(s) → Cu(s) + Cr (aq)
Soal nomor 13
Diketahui data potensial reduksi standar sebagai berikut.
Zn2+ + 2e → Zn Eo = -0,76 V
Mg2+ + 2e → Mg Eo = -2,38 V
Cu2+ + 2e → Cu Eo = +0,34 V
Notasi sel yang dapat berlangsung spontan adalah ….
A. Fe |Fe2+ ||Zn2+ |Zn
B. Zn |Zn2+ ||Mg2+ |Mg
C. Cu |Cu2+ ||Zn2+ |Zn
D. Cu |Cu2+ ||Fe2+ |Fe
E. Mg |Mg2+ ||Cu2+ |Cu
Soal nomor 14
Jika diketahui :
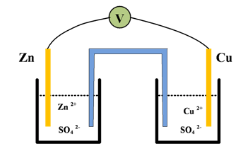
Zn+2 / Zn Eo = –0, 76 Volt
Cu+2 / Cu Eo = +0,34 Volt
maka besarnya potensial sel (Eo sel) Volta tersebut adalah ….
A. –0,42 Volt
B. –1,10 Volt
C. +0,42 Volt
D. +1,10 Volt
E. +11,0 Volt
Soal nomor 15
Gambar berikut ini yang bukan termasuk contoh sel Volta yang digunakan dalam kehidupan
sehari-hari adalah ….
A. 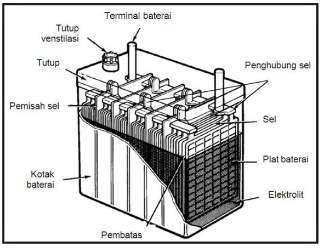
B. 
C.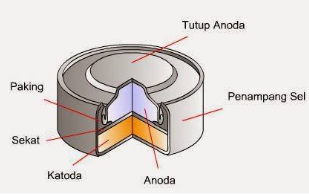
D. 
E. 
Soal nomoe 16
Logam Y dapat mendesak logam Z dari larutannya, logam X dapat mendesak logam Z dari larutannya, sedangkan logam X tidak dapat mendesak logam Y dari larutannya. Urutan potensial reduksi yang makin negatif adalah ….
A. Y – X – Z
B. Z – X – Y
C. Z – Y – X
D. X – Z – Y
E. X – Z – Y
Baca : Contoh Soal Sel Elektrolisis dan Hukum Faraday Kimia Kelas 12 SMA MA
Soal nomor 17
Berikut ini pernyataan yang benar tentang anoda dan katoda adalah ….
A. anoda kutub positif
B. katoda kutub negatif
C. anoda tempat oksidasi
D. katoda tempat oksidasi
E. katoda dan anoda tempat reaksi oksidasi
Soal nomor 18
Beberapa alat yang menggunakan prinsip kerja sel volta adalah ….
A. accu dan baterai
B. accu dan strika
C. baterai dan AC
D. Televisi dan kipas angin
E. baterai dan dinamo
Soal nomor 19
Sel volta adalah ….
A. sel yang menghasilkan energi gerak dari energi kimia
B. sel yang menghasilkan energi kimia dari energi listrik
C. sel yang menghasilkan energi listrik dari energi kimia
D. sel yang menghasilkan energi panas dari energi kimia
E. sel yang menghasilkan energi lua dari energi kimia
Soal nomor 20
Logam yang dapat melindungi besi (Eo = -0,44 volt) dari korosi dengan metode proteksi katodik adalah ….
A. Pb (Eo = 0,13 volt)
B. Cu (Eo = +0,34 volt)
C. Sn (Eo = -0,14 volt)
D. Cd (Eo = -0,40 volt)
E. Zn (Eo = -0,76 volt)
Kunci Jawaban – Unduh
Demikian yang dapat kami bagikan mengenai contoh soal sel volta kimia keals 12 SMA MA Kurikulum 2013. Semoga bermanfaat