Gaya Antarmolekul : Gaya London, Gaya Tarik Dipol, dan Ikatan Hidrogen
Gurubagi.com. Gaya antar molekul adalah gaya yang terjadi antara atom-atom, sehingga dapat membentuk molekul tertentu yang memiliki ikatan sesuai dengan kekuatan atom-atom tersebut.
Gaya tarik antarmolekul berkaitan dengan sifat-sifat fisik zat, seperti titik leleh, titik beku, kelarutan, kerapatan dan titik didih. Pengaruh lainnya, yaitu fasa suatu zat. Fase zat tersebut seperti padat, car dan gas.
Ketika dalam keadaan fasa gas, pada suhu tinggi dan tekanan yang relatif rendah, molekul-molekul dalam zat tersebut akan benar-benar berdiri sendiri tanpa adanya interaksi di dalamnya.
Akan tetapi ketika, pada suhu yang relatif rendah dan dengan tekanan yang cukup tinggi (mendekati titik embunnya), maka besar kemungkinan akan terjadi gaya tarik menarik antarmolekul tersebut.
Oleh karena itu, membutuhkan energi yang tinggi ketika ingin mencairkan suatu zat padat dan atau untuk menguapkan zat cair.
Para ilmuwan menyatakan bahwa, semakin kuat gaya antarmolekul, semakin sulit untuk memutuskan ikatannya, sehingga titik leleh dan titik didih suatu senyawa semakin tinggi.
Selain itu gaya tarik-menarik timbul karena adanya perbedaan elektronegativitas pada suatu atom. Elektron yang berperan dalam hal ini adalah elektron pada kulit terluar.
Baca : Bentuk Molekul Berdasarkan Teori Domain Elektron dan Teori Hibridisasi
Gaya Tarik Menarik Antarmolekul
Berikut ini adalah 3 (tiga) jenis gaya tarik menarik antarmolekul.
1. Gaya London
Elektron bergerak pada lintasannya masing-masing dalam orbital atom, perpindahannya pada suatu atom dapat mengakibatkan tidak meratanya kepadatan elektron pada atom.
Hal ini mengakibatkan atom tersebut mempunyai satu sisi dipol dengan muatan lebih negatif daripada sisi yang lain, sehingga menimbulkan dipol sesaat. Gaya tarik menyebabkan molekul yang bersifat non-polar menjadi bersifat agak polar.

Dipol sesaat pada suatu molekul dapat mengimbas molekul sekitarnya, sehingga membentuk dipol terimbas dan menghasilakn gaya tarik menarik yang lemah. Gaya tarik menarik ini, yaitu gaya London.
Gaya London merupakan gaya yang terjadi akibat adanya tarik-menarik terinduksi akibat adanya gaya dipol-dipol sementara dalam suatu senyawa.

Kemudahan suatu molekul untuk membentuk dipol sesaat atau untuk mengimbas terkenal dengan nama polarisabilitas. Polarisabilitas berkaitan dengan massa molekul relatif (Mr) dan bentuk molekul.
Semakin besar massa molekul relatif, molekul semakin mudah mengalami polarisabilitas sehingga semakin kuat gaya Londonnya.
Contoh Soal :
Urutkan kekuatan Gaya London dari molekul-molekul berikut ini!
a. H2(Ar H = 1)
b. O2(Ar O = 16)
c. N2(Ar N = 14)
d. Br2(Ar Br = 80)
Pembahasan :
Semakin besar Mr suatu molekul, maka akan semakin besar pula gaya London-nya, sehingga urutan kekuatan gaya London dari molekul tersebut adalah:
H2 < N2 < O2 < Br2 karena Mr Br2 > Mr O2 > Mr N2 > Mr H2.
Jika terdapat permasalah untuk perbandingan Gaya London antara 2 moleku dengan l Mr yang sama, maka molekul dengan struktur panjang mempunyai kemungkinan lebih besar untuk mengalami polalarisabilitas.
Hal ini terjadi karena molekul dengan struktur panjang mempunyai bidang yang lebih luas bila daripada molekul yang memiliki struktur lebih rapat dan kecil.
Perhatikan senyawa neopentana dan normal pentana merupakan contoh 2 molekul dengan Mr sama.

Molekul dengan struktur panjang, yaitu n-pentana lebih mudah mengalami polarisasi dari pada molekul dengan struktur yang rapat dan kecil.
2. Gaya Tarik Dipol-Dipol
Gaya tarik dipol adalah gaya yang terjadi antara molekul-molekul polar, yaitu molekul-molekul yang memiliki momen dipol.
Molekul-molekul ini cenderung menyusun diri dengan cara saling mendekatkan ujung yang berbeda, muatan (ujungpositif dari suatu molekul dengan ujung negatif molekul lainnya).
Sebenarnya gaya ini merupakan gaya elektrostatik yang terjadi karea pengaruh nilai keelektronegatifan dalam suatu unsur. Susunan molekul seperti ini akan menghasilakn gaya tarik menarik, yaitu gaya tarik dipol-dipol.
Gaya tarik ini, lebih kuat dari gaya dispersi (gaya london), sehingga senyawa polar cenderung mempunyai titik didih dan titik cair yang lebih tinggi dari pada senyawa non polar dengan masa molekul yang hampir sama.
Selain itu, senyawa polar memiliki sebaran elektron yang tidak merata karena perbedaan keelektronegatifannya yang besar dan menyebabkan suatu atom terbagi menjadi dua muatan, satu ujung memiliki muatan positif dan lainnya bermuatan negatif.
Ujung positif cenderung akan berdekatan dengan ujung negatif atom lain di dekatnya. Keadaan ini terjadi karena adanya gaya tarik menarik dipol pada molekul tersebut, seperti gaya tarik molekul HCl berikut.
3. Ikatan Hidrogen
Ikatan hidrogen adalah ikatan antara molekul yang sangat polar dan mengandung atom hidrogen, yang dapat terjadi antara unsur yang sangat elektronegatif (F,O, dan N) dan hidrogen.
Misalkan keelektronegatifan dari molekul H2O, HF, dan NH3, atom H mempunyai sifat sangat positif, sedangkan atom O, F, dan N mempunyai sifat sangat negatif.
Di dalam molekul air , atom O bersifat sangat elektronegatif, sehingga pasangan elektron antara atom O dan H tertarik ke arah atom O, akibatnya terbentuk dipol berikut.

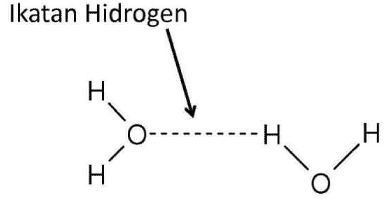
Perbedaan keelektronegatifan yang besar ini menyebabkan atom H terikat kuat pada atom O, F dan N, maka ikatan inilah yang para ilmuwa sebut dengan ikatan hidrogen.
Antara atom hidrogen dan atom oksigen yang berlainan molekul terjadi semacam jembatan penghubung yaitu ikatan hidrogen. Ikatan hidrogen jauh lebih kuat dari pada gaya-gaya Van der Waals.
Zat mempunyai ikatan hidrogen mempunyai titik didih dan titik cair lebih tinggi karena untuk memutuskan ikatan hidrogen memerlukan energi yang sangat besar.
Demikian ulasan mengenai gaya London, gaya tarik dipol, dan ikatan Hidrogen. Semoga bermanfaat.




