Konfigurasi Elektron : Pengertian dan Aturan Penulisannya
Gurubagi.com. Elektron dalam atom bergerak di sekeliling inti atom pada masing-masing orbitnya yang disebut kulit elektron. Elektron tersebut tersusun dalam atom yang disebut dengan konfigurasi elektron.
Dengan kata lain Konfigurasi elektron adalah susunan elektron pada subkulit atom dalam orbital atom atau molekulnya.
Melalui konfigurasi elektron dapat menentukan golongan (elektron valensi) dan periode (Jumlah kulit elektron juga menyatakan ) suatu unsur.
Aturan Penulisan konfigurasi elektron
1. Aturan teori Atom Niels Bohr

Niels Henrik Bohr (1913) adalah adalah seorang ilmuwan Denmark . Berdasarkan teori atom Niels Bohr ini, elektron pada atom akan menempati kulit-kulit atom.
Dalam Teori Atom Bohr, elektron mengikuti orbit melingkar pada jarak tertentu dari inti. Lapisan K, yang mengorbit paling dekat dengan inti (n = 1), memiliki energi paling rendah
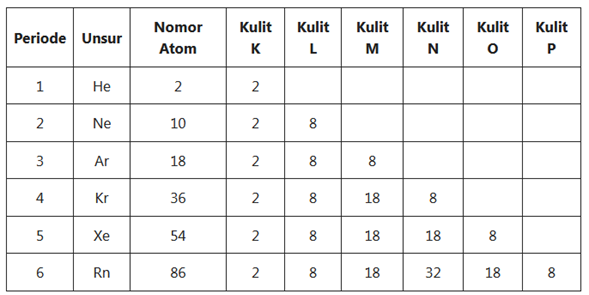
Hal ini dikarenakan semakin besar nomor kulit maka semakin besar ruang cakupannya. Jumlah maksimum elektron di setiap kulit akan memenuhi rumus 2n²(n merupakan nomor kulit). Perhatikan gambar di bawah ini.
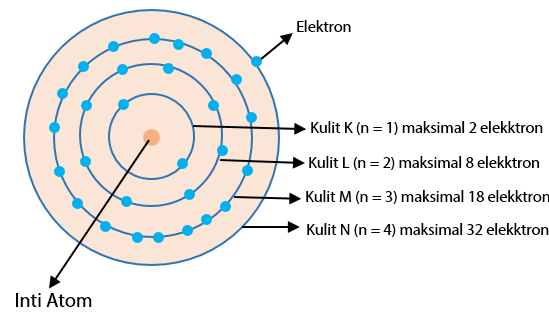
- Kulit K (kulit atom n = 1) maksimal elektron 2 x 1² = 2 elektron
- Kulit L (kulit atom n = 2) maksimal elektron 2 x 2² = 8 elektron
- Kulit M (kulit atom n = 3) maksimal elektron 2 x 3² = 18 elektron
- Kulit N (kulit atom n = 4) maksimal elektron 2 x 4² = 32 elektron
- Kulit O (kulit atom n = 5) maksimal elektron 2 x 5² = 50 elektron
Contoh soal
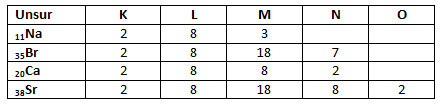
Tentukan konfigurasi elektron untuk
a. 11Na
b.35Br
c. 20 Ca
d. 38Sr
Pembahasan :
Konfigurasi elektron gas mulia
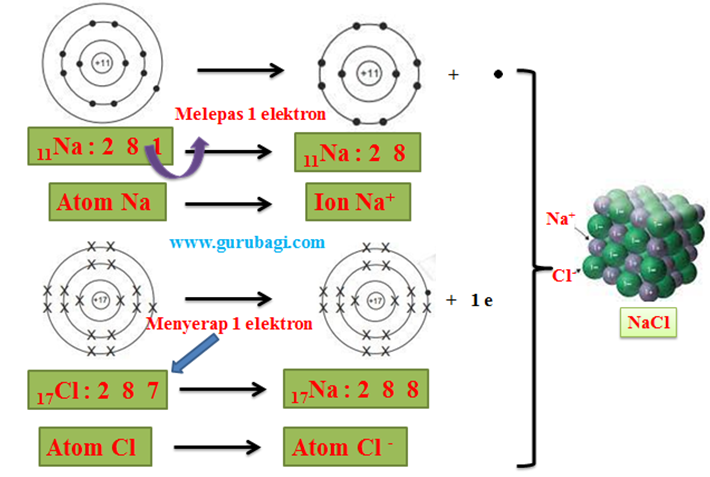
Kestabilan unsur gas mulia dikarenakan susunan elektron gas mulia berjumlah 8 di kulit paling luar, kecuali atom helium (memiliki konfigurasi elektron penuh).
Aturan mengenai konfigurasi elektron gas mulia dengan 8 elektron di kulit terluar disebut konfigurasi octet sementara atom helium memiliki konfigurasi duplet.
2. Asas Aufbau
Berdasarkan asas Aufbau, pengisian elektron pada orbital dimulai dari subkulit yang memiliki tingkat energi lebih rendah ke tingkat energi yang lebih tinggi.
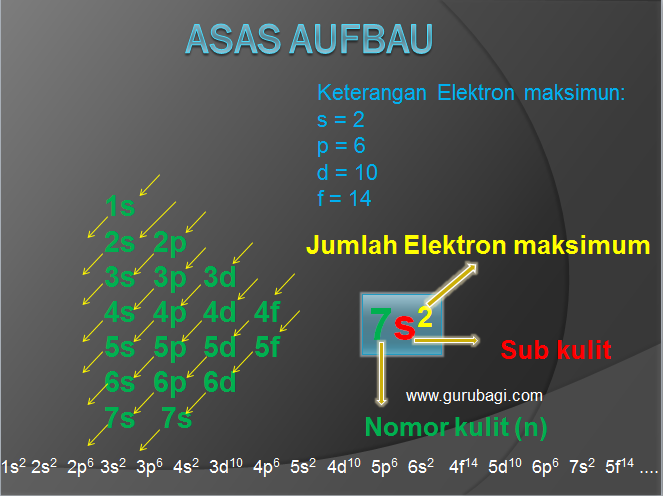
Pada saat pengisian elektron subkulit dengan tingkat energi diisi penuh dahulu kemudian sisanya menempati subkulit tingkat energi berikutnya dengan urutan sebagai berikut:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 ….
Contoh soal
Tentukan konfigurasi elektron untuk
a. 11Na
b.35Br
c. 20 Ca
d. 38Sr
Pembahasan :
Tentukan konfigurasi elektron untuk
a. 11Na = 1s2 2s2 2p6 3s1
b.35Br = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
c. 20 Ca = 1s2 2s2 2p6 3s2 3p6 4s2
d. 38Sr = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
Baca : Konfigurasi Elektron, Diagram Orbital, Contoh Soal, dan Pembahasannya
Demikian Pengertian konfigurasi elektron dan atura penulisannya. Semoga bermanfaat.