Latihan Soal Kimia Sel Elektrolisis Kelas 12 SMA MA Kurikulum 2013
Gurubagi.com. Berikut ini kami bagikan latihan soal kimia sel elektrolisis mata pelajaran kimia kelas 12 SMA MA kurikulum 2013
Latihan soal kimia sel elektrolisis kelas 12 SMA MA ini untuk membantu belajar peserta didik dalam memahami materi kimia tentang sel elektrolisis.
Bentuk latihan soal kimia sel elektrolisis kelas 12 SMA/MA ini adalah Pilihan Ganda dengan lima alternatif jawaban dan sudah tersedia kunci jawabannya yang dapat di unduh dengan mudah.

Soal nomor 1
Elektrolisis adalah proses perubahan dari…
A. reaksi Kimia menjadi energi listrik
B. energi Listrik menjadi reaksi Kimia
C. energi Listrik menjadi oksidasi
D. energi Listrik menjadi reduksi
E. reaksi reduksi menjadi energi listrik
Soal nomor 2
DidalameElektrolisis digunakan 2 buah elektroda yang bermuatan, pernyataan ini yang benar adalah ….
A. katoda bermuatan positif dan anoda bermuatan netral
B. katoda bermuatan negatif dan anoda bermuatan netral
C. katoda bermuatan negatif dan anoda bermuatan positif
D. katoda bermuatan netral dan anoda bermuatan negatif
E. katoda bermuatan positif dan anoda bermuatan negatif
Soal nomor 3
Perhatikan gambar di bawah ini!
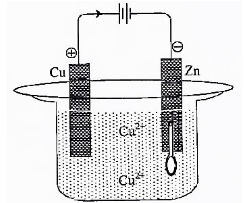
Sendok logam yang terbuat dari zink akan disepuh dengan logam tembaga. Reaksi yang terjadi di katoda adalah ….
A. Cu2+(aq) + Zn(s) → Cu(s) + Zn2+(aq)
B. Zn(s) → Zn2+(aq) + 2e
C. Zn2+(aq) + 2e → Zn(s)
D. Cu(s) → Cu2+(aq) + 2e
E. Cu2+(aq) + 2e → Cu(s)
Soal nomor 4
Perhatikan peristiwa elektrolisis berikut!
(1) Lelehan NaBr dengan elektrode platina
(2) Larutan K2SO4 dengan elektrode karbon
(3) Lelehan KCl dengan elektrode platina
(4) Larutan CuSO4 dengan elektrode karbon
Pasangan reaksi di anoda yang menghasilkan gas O2 terjadi pada nomor :
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Soal nomor 5
Perhatikan sel elektrolisis berikut ini!
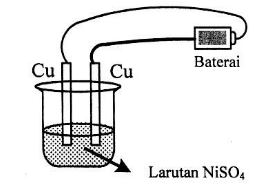
Reaksi yang terjadi di anoda adalah ….
A. Ni2+(aq) + 2e → Ni(s)
B. Cu(s) → Cu2+(aq) + 2 e
C. 2H2O(l) → 4H+(aq) + O2(g) + 4e
D. SO2-(aq) + 4 H+(aq) + 2e → 2 H2O(1) + SO2(g)
E. 2H2O + 2e –> H2 + 2OH–
Soal nomor 6
Perhatikan bagan elektrolisis di bawah ini!
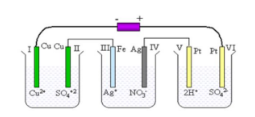
Elektrode yang menghasilkan gas adalah ….
A. I dan II
B. III dan V
C. III dan IV
D. II dan IV
E. V dan VI
Soal nomor 7
Salah satu aplikasi penerapan sel elektrolisis adalah elektroplating jika seorang siswa ingin melapisi gelang dengan perak pernyataan di bawah yang tepat adalah ….
A. gelang diletakkan pada elektrode anode
B. logam perak diletakkan elektrode anode
C. menggunakan larutan tembaga sulfat
D. menggunakan elektrode karbon
E. menggunakan elektrode platina
Soal nomor 8
Pada elektrolisis larutan tembaga (II) sulfat dengan elektrode perak , di anode terjadi reaksi ….

A. Cu2+ + 2e → Cu
B. Ag → Ag+ + e
C. 2H2O + 2e → 2OH– + H2
D. 2H2O → 4H+ + O2 + 4e
E. H2 → 2H+ + 2e
Soal nomor 9
Pada elektrolisis larutan tembaga (II) sulfat dengan elektrode besi di katode, dan di anode elektrode tembaga, di katode setelah elektrolisis akan terjadi …..
A. endapan tembaga
B. endapan besi
C. gas oksigen
D. gas klorin
E. ion OH–
Soal nomor 10
Perhatikan gambar elektrolisis di bawah!
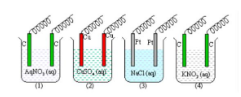
Elektrolisis yang menghasilkan logam ditunjukkan pada gambar nomor ….
A. 2 dan 3
B. 1 dan 2
C. 2 dan 4
D. 1 dan 4
E. 3 dan 4
Soal nomor 11
Soal nomor 12
Pada elektrolisis larutan AgNO3 dengan menggunakan elektrode Ag, persamaan reaksi yang terjadi pada anoda adalah ….
A. Ag+(aq) + → Ag(s)
B. Ag(s) → Ag+(aq) + e
C. 2H2O(l) → O2(aq) + 4H+(aq) + e
D. 2H2O(l) + 2e → H2(g) + 2OH–(aq)
E. 2NO3–(aq) → 2NO2(g) + O2(g) + 2e
Soal nomor 13
Pada elektrolisis larutan NaCl dengan elektroda Pt, maka reaksi yang terjadi di katoda adalah ….
A. Na+(aq) + e → Na(s)
B. NaCl(aq) → Na+(aq) + Cl–(aq)
C. 2H2O(l) + 2e → H2(g) + 2OH–(aq)
D. 2H2O(l) → O2(g) + 4H+(aq) + 4e
E. 2Cl–(aq) → Cl2(g) + 2e
Soal nomor 14
Jika larutan tembaga (II) sulfat dielektrolisis dengan elektroda tembaga, pada katoda akan terbentuk ….
A. uap air
B. ion hidroksida
C. logam tembaga
D. asam sulfat
E. gas hidrogen
Baca : Latihan Soal Gas Mulia Kimia Kelas 12 SMA MA dan Kunci Jawabannya
Soal nomor 15
Larutan di bawah ini yang akan menghasilkan gas pada anoda dan katoda jika dielektrolisis dengan menggunakan elektroda Pt adalah larutan ….
A. K2SO4
B. AgNO3
C. CuSO4
D. KBr
E. NaI
Soal nomor 16
Pada elektrolisis larutan KCl diperoleh hasil ….
A. logam K dan Cl2
B. logam K dan HCl
C. KOH dan gas Cl2
D. KOH, gas H2 dan Cl2
E. logam K, gas Cl2 dan gas H2
Soal nomor 17
Perhatikan pada elektrolisis seperti gambar di bawah ini!
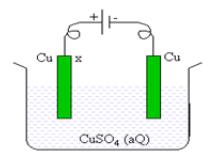
persamaan yang menunjukan reaksi pada elektroda X adalah ….
A. H2O(l) →2H+(aq)+ 1/2O2 + 2e
B. Cu2+(aq) + 2e → Cu(s)
C. Cu(s) → Cu2+ (aq) + 2e
D. 2H2O(l) + 2e → H2(g) + 2OH–(aq)
E. 2H2O(l) + O2(l) + 4e– → 4OH–(aq)
Soal nomor 18
Elektrolisis larutan KCl menggunakan elektroda karbon akan menghasilkan ….
A. Logam K di katoda
B. Gas Cl2 di katoda
C. Gas H2 di katoda
D. larutan basa di anoda
E. Gas O2 di anoda
Soal nomor 19
Perhatikan gambar di bawah ini!
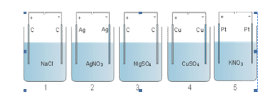
Peristiwa elektrolisis dari ke lima gambar di atas yang menghasilkan gas pada suhu kamar di kedua elektrodanya adalah ….
A. 1 dan 2
B. 4 dan 5
C. 2 dan 4
D. 1 dan 3
E. 2 dan 5
Soal nomor 20
Perhatikan gambar beberapa sel elektrolisis berikut ini!
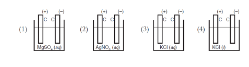
Sel elektrolisis yang menghasilkan gas oksigen adalah ….
A. 1 dan 2
B. 1 dan 3
C. 2 dan 3
D. 3 dan 4
E. 4 saja
Kunci jawaban latihan soal sel elektrolisis kimia kjelas 12 dapat unduh disini
Demikian yang dapat kami bagikan menganai latihan soal kimia sel elektrolisis kelas 12 MA SMA. Semoga bermanfaat