Latihan Soal Kimia Termokimia Kelas 11 SMA dan Kunci Jawabannya
Gurubagi.com. Berikut ini kami bagikan latihan soal Kimia materi Termokimia kelas 11 SMA dan kunci jawabannya.
Latihan soal Kimia materi Termokimia kelas 11 SMA dan kunci jawabannya ini untuk membantu belajar peserta didik dalam memahami materi Kimia tentang Termokimia.
Termokimia merupakan salah satu bentuk penerapan hukum pertama termodinamika Jterhadap peristiwa kimia yang membahas tentang perubahan kalor yang menyertai suatu reaksi kimia.
Contoh soal kimia materi Terrmokimia ini berbentuk Pilihan Ganda dengan lima alternatif jawaban dan sudah tersedia kunci jawabannya yang dapat di unduh dengan mudah.

Soal nomor 1
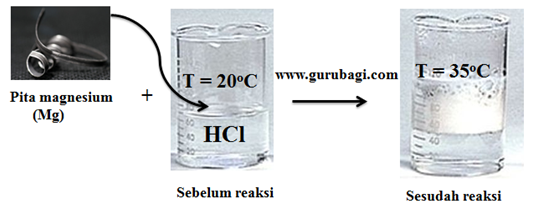
Jika reaksi antara logam barium dan asam klorida encer dicampurkann ke dalam tabung reaksi yang tertutup dengan rapat, gas hidrogen di dalam sistem tidak dapat meninggalkan sistem. Akan tetapi perambatan kalor meninggalkan sistem tetap terjadi melalui dinding pada tabung reaksi.
Pada percobaan ini termasuk ke dalam …
A. sistem terbuka
B. perubahan entalpi
C. sistem tertutup
D. perubahan energi dalam
E. sistem terionisasi
Soal nomor 2
Peristiwa berikut yang termasuk ke dalam reaksi endoterm adalah ….
A. besi berkarat
B. pembuatan es batu
C. air mengalir
D. ledakan bom
E. pembakaran kayu
Soal nomor 3
Proses reaksi di alam yang berlangsung spontan, seperti pertunjukan kembang api merupakan salah satu contoh dari reaksi ….
A. kimia
B. eksoterm
C. endoterm
D. sistem terbuka
E. perubahan entalpi
Soal nomor 4
Sepotong logam barium direaksikan dengan asam klorida encer pada sistem terbuka dengan reaksi Ba + 2HCl –> BaCl2 + H2.
Pada reaksi tersebut, sistem melepaskan kalor akan menyebabkan terjadinya perubahan volume. Sistem ini juga melakukan kerja sebesar 45 kJ.
Besarnya perubahan energi dalam proses tersebut adalah ….
A. -195 kJ
B. +185 kJ
C. -162,8 kJ
D. +195 kJ
E. +162,7 kJ
Soal nomor 5
Jika pada suatu persamaan reaksi semua zat diketahui harga Htº masing-masing. ΔH reaksi tersebut dapat dihitung dengan rumus ….
A. ΔH = Hakhir – Hawal
B. ΔH = ΔHt hasil reaksi – ΔHt pereaksi
C. ΔH = qpereaksi
D. ΔH = U + ρV
E. ΔH = ΔHt pereaksi – ΔHt pereaksi
Soal nomor 6
Diketahui energi ikatan rata-rata :
C ≡ C = 839 kJ/mol
C – C = 348 kJ/mol
H – H = 436 kJ/mol
C – H = 415 kJ/mol
Perubahan entalpi yang terjadi pada reaksi :
CH3 – C ≡ CH + 2H2 –> CH3 – CH2 – CH3 sebesar ….
A. +477 kJ/mol
B -477 kJ/mol
C. -1.711 kJ/mol
D. -1.983 kJ/mol
E. -3.694 kJ/mol
Soal nomor 7
Jika 100 mL larutan NaOH 1 M direaksikan dengan 100 mL larutan HCl 1 M dalam sebuah kalorimeter, suhu larutan naik dari 29ºC menjadi 37,5ºC. Jika kalor jenis larutan 4,2 J/gK dan massa jenis larutan dianggap 1 g/mL, maka persamaan reaksi termokimia yang terjadi adalah ….
A. NaOH(aq) + HCl(aq) –> NaCl(aq) + H2O(l)
ΔH = +82,3 kJ/mol
B. NaOH(aq) + HCl(aq) –> NaCl(aq) + H2O(l)
ΔH = +7,14 kJ/mol
C. NaOH(aq) + HCl(aq) –> NaCl(aq) + H2O(l)
ΔH = -4,59 kJ/mol
D. NaOH(aq) + HCl(aq) –> NaCl(aq) + H2O(l)
ΔH = -5,46 kJ/mol
E. NaOH(aq) + HCl(aq) –> NaCl(aq) + H2O(l)
ΔH = -71,4 kJ/mol
Soal nomor 8
Perhatikan data pada suhu 25ºC berikut!
| 2NOCl(g) –> 2NO(g) + Cl2(g) | ΔH = +75,56 kJ | |
| 2NO(g) + O2(g) –> 2NO2(g) | ΔH = -113,06 kJ | |
| 2NO2(g) –> N2O4(g) | ΔH = -58,03kJ |
ΔH pada suhu 25ºC untuk reaksi N2O4(g) + Cl2(g) –> 2NOCl(g) + O2(g) adalah ….
A. +95,53 kJ
B. -85,52 kJ
C. +299 kJ
D. -246,65 kJ
E. -186,80 kJ
Soal nomor 9
Data energi ikatan rata-rata :
C – C = 348 kJ/mol
C – H = 414 kJ/mol
C – O = 358 kJ/mol
O – H = 463 kJ/mol
O = O = 495 kJ/mol
C = O = 799 kJ/mol
Spitirus yang mengandung etanol dibakar dengan persamaan reaksi :
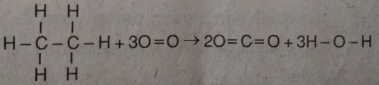
Perubahan entalpi yang dihasilkan untuk pembakaran tersebut adalah ….
A. -6.710 kJ
B. -3.355 kJ
C. -1.250 kJ
D. +1.250 kJ
E. +6.710 kJ
Soal nomor 10
Perhatikan gambar percobaan berikut!
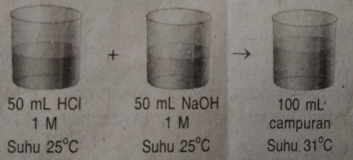
Apabila massa jenis air = 1 g/mL dan kalor jenis air = 4,2 J/gºC, nilai ΔH reaksi : HCl(aq) + NaOH(aq) –> NaCl(aq) + H2O(l) per mol H2O yang terbentuk adalah ….
A. -25,2 kJ
B. -50,4 kJ
C. -54,6 kJ
D. -55,44 kJ
E. -57,1 kJ
Soal nomor 11
Diketahui perubahan entalpi pembakaran zat sebagai berikut.
ΔHcº C6H6(l) = -3.267 kJ
ΔHcº H2(g) = -286 kJ
ΔHcº C(s) = -394 kJ
Berdasarkan data tersebuut, ΔHcº pembentukan benzena cair adalah ….
A. -135 kJ/mol
B. -90 kJ/mol
C. -45 kJ/mol
D. +45 kJ/mol
E. +90 kJ/mol
Soal nomor 12
Tabel berikut menyajikan data entalpi pembakaran untuk lima jenis bahan bakar.
| Bahan Bakar | ΔH (kJ/mol) | Mr |
| Hidrogen | -287 | 2 |
| Metana | -803 | 16 |
| Propana | -2.201 | 44 |
| Isobutana | -2.868 | 56 |
| Neopentana | -3.515 | 72 |
Pembakaran 1 gram bahan bakar yang menghasilkan energi paling besar adalah ….
A. hidrogen
B. metana
C. propana
D. isobutana
E. neopentana
Soal nomor 13
Perhatikan beberapa persamaan reaksi dalam kehidupan sehari-hari berikut!
(1) C6H12O6(aq) –> 2C2H5OH(aq) + 2CO2(g)
(2) C6H12O6(aq) + O2(g) –> 6CO2(g) + 6H2O(l)
(3) H2O(aq) –> H2(g) + 0,5 O2(g)
(4) C8H18(g) + 12,5 O2(g) –> 8CO2(g) + 9H2O
(5) C(s) + 2H2O(g) –> CO2(g) + 2H2(g)
Reaksi eksoterm terjadi pada nomor ….
A. (1) dan (3)
B. (1) dan (5)
C. (2) dan (4)
D. (2 ) dan (5)
E. (3) dan (5)
Soal nomor 14
Diketahui ΔHtº CO2 = -393,5 kJ/mol dan ΔHtº H2O = -241,8 kJ/mol, maka ΔHtº C2H4 pada reaksi : C2H4(g) + 3O2(g) –> 2CO2(g) + 2H2O(g) (ΔH = -1.323 kJ) adalah ….
A. -87,2 kJ/mol
B. -52,4 kj/mol
C. +52,4 kJ/mol
D. +87,2 kJ/mol
E. +92 kJ/mol
Soal nomor 15
Diketahui entalpi reaksi :
CH2 = CH2 + HCl –> CH3CH2Cl adalah ….
A. -312 kJ/mol
B. -54 kJ/mol
C. +54 kj/mol
D. +100 kJ/mol
E. +312 kJ/mol
Kunci jawaban dari soal Kimia materi Termokimia tersebut dapat di unduh di sini.
Baca : Contoh Soal Kimia Minyak Bumi Kelas 11 SMA dan Kunci Jawabannya
Demikian yang dapat kami bagikan mengenai contoh soal Kimia materi Termokimia kelas 11 SMA dan kunci jawabannya. Semoga bermanfaat.