Latihan Soal PTS 2 Kimia Kelas 10 SMA Tahun 2023
Gurubagi.com. Berikut ini dibagikan latihan soal PTS semester 2 kimia untuk kelas 10 SMA/ SMK/MA Tahun Pelajaran 2022/ 2023.
Contoh soal PTS Kimia 10 Tahun 2023 ini untuk membantu belajar peserta didik kelas 10 SMA/SMK/MA dalam menghadapi Penilaian Tengah Semester 2 Tahun Pelajaran 2022/2023.
Materi Soal Penilaian Tengah 2 Kimia kelas 10 SMA/SMK/MA diambil dari separuh materi Kimia semester dua.
Baca :
- Soal Tata Nama Senyawa Kelas 10 SMA SMK Dilengkapi Pembahasannya
- Latihan Soal Online Kimia Materi Reaksi Redoks Kelas 10 SMK MA
- Tata Nama Senyawa Ion, Contoh Soal, dan Pembahasannya
Materi soal PTS semester 2 Kimia Kelas 10 SMK/SMK terbagi menjadi tiga bagian, yaitu : (1) Larutan Elektrolit dan Nonelektrolit; (2) Reaksi Reduksi Oksidasi; dan (3) Tata Nama Senyawa.
1. Larutan Elektrolit dan Nonelektrolit
a. Elektrolit
Larutan elektrolit adalah larutan yang dapat menghantarkan listrik. Jenis larutan ini terbagi menjadi dua, yaitu elektrolit kuat dan elektrolit lemah.
Larutan elektrolit kuat adalah larutan yang mempunyai daya hantar listrik kuat, sehingga zat terlarutnya di dalam pelarut (umumnya air) seluruhnya berubah menjadi ion-ion (α = 1).
Berikut ini adalah contoh larutan elektrolit kut
- Asam-asam kuat, contohnya adalah HCl, HCl03, H2SO4, dan HNO3.
- Basa-basa kuat, yaitu basa-basa golongan alkali dan alkali tanah, contohnya adalah NaOH, KOH, Ca(OH)2, dan Ba(OH)2.
- Garam-garam yang mudah larut, contohnya, yaitu NaCl, KI, dan Al2(SO4)3.
Larutan elektrolit lemah adalah larutan yang daya hantar listriknya lemah, sehingga memiliki harga derajat ionisasi sebesar 0 < α < 1.
Berikut ini adalah contoh larutan tergolong elektrolit lemah.
- Asam-asam lemah, contohnya adalah CH3COOH, HCN, H2CO3, dan H2S.
- Basa-basa lemah, contohnya, yaitu NH4OH dan Ni(OH)2.
- Garam-garam yang sukar larut, contohnya adalah AgCl, CaCrO4, dan PbI2.
2. Non Elektrolit
Larutan nonelektrolit merupakan larutan yang tidak dapat menghantarkan arus listrik, sehingga memiliki α = 0.
Berikut adalah contoh larutan elektrolit.
- Urea (CO(NH2)2)
- Sukrosa
- Gula (C12H22o11)
- Glukosa (C6H12O6)
- Alkohol (C2H5OH)
2. Reaksi Reduksi Oksidasi
Reaksi redoks adalah reaksi reduksi dan oksidasi yang berlangsung secara bersamaan. Berikut ini merupakan beberapa pengertian reaksi redoks.
a. Reaksi redoks sebagai reaksi pengikatan dan pelepasan oksigen
- Oksidasi adalah reaksi pengikatan oksigen. Contoh reaksi oksidasi, yaitu perkaratan besi (Fe) dan berubah warna coklat dari bekas gigitan apel.
- Reduksi adalah reaksi pelepasan atau pengurangan oksigen. Contoh reaksi reduksi, yaitu adalah reduksi bijih besi dengan CO.
b. Reaksi redoks sebagai reaksi pelepasan dan pengikatan atau penerimaan elektron
Di dalam setiap oksidasi pasti disertai reduksi, sehingga dapat disebut reaksi redoks.
- Oksidasi adalah reaksi pelepasan elektron, berikut ini contoh (setengah reaksi oksidasi), yaitu K → K+ + e .
- Reduksi adalah reaksi pengikatan atau penerimaan elektron, berikut ini contoh (setengah reaksi reduksi), yaitu Cl2 + 2e → 2Cl–.
c. Reaksi redoks sebagai reaksi kenaikan dan penurunan bilangan oksidasi (biloks)
Bilangan oksidasi atau disingkat biloks adalah muatan yang dimiliki oleh suatu atom akibat melepaskan atau menerima elektron, sehingga mencapai kestabilan seperti gas mulia.
Baca :
3. Tata Nama Senyawa
a. Tata Nama Senyawa Ion
Senyawa ion adalah senyawa yang dibentuk dari unsur logam dan nonlogam, Tata nama senyawa ion dapat dilakukan mengikuti aturan berikut.
Untuk kation yang hanya punya satu bilangan oksidasi : (nama kation) (nama anion + ida)
Berikut adalah contoh pemberian nama senyawa ion
- NaCl = Natrium Klorida
- K2S = Kalium Sulfida
Unsur dengan lebih dari satu biloks (beberapa logam gol IIIA dan beberapa logam transisi gol.B), penamaannya : (nama kation) (bilangan oksidasi kation dalam angka romawi) (nama anion + ida)
Berikut adalah contoh penamaan senyawa yang memiliki lebih satu bilangan oksidasinya.
Fe2O3= besi (III) oksida
Cr2O3 = kromium (III) oksida
b. Tata Nama Senyawa Kovalen
Senyawa kovalen adalah senyawa yang dibentuk dari unsur nonlogam dan unsur nonlogam.
Aturan tata nama senyawa kovalen : (awalan sesuai angka indeks + nama unsur di depan) + ( awalan sesuai angka indeks + nama unsur di belakang + ida)
Contoh :
- N2O5 = dinitrogen pentaoksida
- PCl5= fosforus pentaklorida
Soal PTS Kimia Semester 2 Kelas 10 SMA Tahun 2023

Di bawah ini adalah latihan soal Penilaian Tengah Semester PTS Kimia semester 2 kelas 10 SMA/SMK/MA tahun 2023.
Soal PTS kimia ini berbentuk pilihan ganda dengan lima alternatif pilihan jawaban. Soal sudah dilengkapi dengan kunci jawaban, sehingga dapat lebih mudah dipelajari oleh peserta didik.
Soal nomor 1
Pengertian dari larutan elektrolit kuat adalah larutan yang …
a. dapat menghantar arus Listrik
b. memiliki ion-ion yang tidak terurai
c. tidak terionisasi
d. tidak dapat menghantarkan Listrik
e. tidak akan terurai menjadi ion-ion
Soal nomor 2
Larutan nonelektrolit adalah larutan yang …
a. dapat menghantarkan arus listrik
b. tidak dapat menghantarkan arus listrik
c. selalu aktif
d. mempunyai daya hantar listrik yang sama
e. memiliki ion-ion
Soal nomor 3
Larutan elektrolit dapat menghantarkan arus listrik, karena ….
a. di dalam suatu larutan tersebar molekul-molekul
b. atom-atomnya terdistribusi merata
c. terdapat ion-ion yang bergerak bebas
d. molekul-molekunya meyerap elektron
e. molekul-molekulnya menyerap arus listrik
Soal nomor 4
Dua buah larutan A dan B diuji menggunakan alat uji elektrolit. Lampu alat uji menyala terang, jika menguji larutan A dan timbul gelembung-gelembung gas pada elektrodenya. Akan tetapi, jika larutan B diuji, lampu tidak menyala dan ada gelembung-gelembung gas pada elektrodenya.
Berdasarkan pengamatan tersebut, maka dapat disimpulkan bahwa ….
a. larutan A elektrolit lemah dan larutan B non elektrolit
b. larutan A dan Larutan B elektrolit kuat
c. larutan A elektrolit kuat dan larutan B elektrolit lemah
d. larutan A non elektrolit dan larutan B elektrolit kuat
e. larutan A dan B memiliki kesamaan merata
Soal nomor 5
Jika suatu larutan memiliki data, antara lain lampu tidak menyala dan pada elektrode timbul gelembung gas. Oleh karena itu, berdasarkan data tersebut dapat disimpulkan bahwa ….
a. larutan tersebut nonelektrolit
b. larutan mengandung sedikit ion bebas
c. di dalam air semua berbentuk molekul
d. alat uji tidak bekerja dengan baik
e. semua opsi benar
Soal nomor 6
Berikut ini adalah contoh beberapa larutan.
- NaCl
- CH3COOH
- C2H5OH
- H2SO4
- HCN
Berdasarkan contoh larutan di atas, maka larutan yang bersifat Elektrolit lemah adalah .…
a. 2 dan 3
b. 1 dan 5
c. 3 dan 4
d. 1 dan 4
e. 2 dan 5
Soal nomor 7
Berikut ini reaksi ionisasi pada senyawa H2SO4 yang benar. yaitu ….
a. H2SO4 → H2 + SO4
b. H2SO2 → H2 + SO42-
c. H2SO4 → 2H+ + SO42-
d. H2SO4 → 2H2 + SO4
e. H2SO4 → 2H2 + 2SO4
Soal nomor 8
Zat-zat dibawah ini yang merupakan deretan elektrolit lemah adalah ….
a. HCl, H2SO4, HNO3
b. CH3COOH, HF, NH3
c. CH3OH, HF, NH3
d. HCL, H2O, H2SO4
e. NaOH, HF, NaCl
Soal nomor 9
Berikut larutan yang dapat menghantarkan listrik paling baik, yaitu ….
a. larutan gula 0,1 M
b. larutan asam asetat 0,1 M
c. larutan asam asetat 1 M
d. larutan NaCl 0,1 M
e. larutan NaCl 1 M
Soal nomor 10
Kristal NaCl tidak menghantar listrik, sedangkan larutan NaCl dapat menghantarkan listrik. Simpulan dari pernyataan tersebut adalah ….
a. kristal NaCl ion, sehingga ionnya bebas bergerak
b. kristal NaCl ion, sehingga ion tidak bebas bergerak, sedangkan larutan NaCl ion-ionnya bergerak bebas.
c. NaCl merupakan senyawa ion, sehingga menghatrakan listrik
d. NaCl merupakan senyawa kovalen, sehingga menghantarkan listrik
e. larutan, NaCl menyerap ion positif dan ion negatif dari air, sehingga menghantarkan listrik.
Soal nomor 11
Berdasarkan percobaan daya hantar listrik beberapa larutan yang telah dilakukan oleh beberapa peserta didik, didapatkan data sebagai berikut.
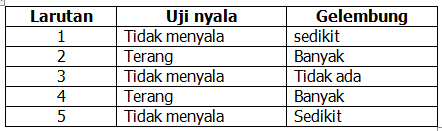
Berdasarkan data tersebut diatas, dapat disimpulkan bahwa larutan yang termasuk elektrolit lemah dan kuat berturut-turut, yaitu larutan nomor ….
a. 1 dan 2
b. 1 dan 3
c. 2 dan 5
d. 3 dan 5
e. 4 dan 5
Soal nomor 12
Berikut adalah gambar uji daya hantar listrik beberapa larutan.

Berdasarkan gambar di atas, dapat telihat pasangan larutan yang bersifat elektorlit lemah dan non elektrolit berturut-turut, yaitu ….
a. I dan II
b. I dan III
c. II dan III
d. II dan IV
e. III dan IV
Soal nomor 13
Perhatikan gambar pengujian daya hantar beberapa larutan ini!

Berdasarkan pengujian daya hantar listrik di atas larutan yang bersifat elektrolit kuat dan elektrolit lemah berturut-turut, yaitu ….
a. 1 dan 2
b. 1 dan 3
c. 1 dan 5
d. 2 dan 3
e. 4 dan 5
Soal nomor 14
Berikut ini adalah pernyataan yang tidak benar tentang reaksi reduksi, yaitu ….
a. pelepasan oksigen
b. pengurangan bilangan oksidasi
c. penerimaan elektron
d. zat reduktor
e. zat oksidator
Soal nomor 15
Proses perkaratan besi pada suhu kamar di tentukan oleh adanya ….
a. oksigen saja
b. air dan nitrogen
c. oksigen dan air
d. air dan argon
e. air saja
Soal nomor 16
Pengertian dari reaksi auto redoks adalah reaksi redoks dimana ….
a. pereaksinya mengalami oksidasi
b. pereaksinya mengalami reduksi
c. pereaksinya mengalami oksidasi dan reduksi
d. reaksinya mengalami reduksi
e. hasil reaksinya mengalami oksidasi
Soal nomor 17
Nilai bilangan okidasi dari S di dalam Na2SO3 adalah ….
a. +2
b. +3
c. +4
d. +5
e. +6
Soal nomor 18
Bilangan oksidasi S dalam senyawa SO42-, yaitu ….
a. +3
b. +4
c. +5
d. +6
e. +7
Soal nomor 19
Senyawa dibawah ini yang memiliki bilangan oksidasi unsur hidrogennya = –1, yaitu ….
a. NH3
b. HNO3
c. NaH
d. H2O
e. PH3
Soal nomor 20
Bilangan oksidasi tertinggi dari atom Cl terdapat pada senyawa ….
a. KCl
b. KClO
c. CaCl2
d. KClO3
e. AlCl3
Soal nomor 21
Berdasarkan reaksi berikut ini yang merupakan contoh terjadinya reaksi oksidasi, yaitu ….
a. Cu2+ → Cu
b. F2 → F–
c. Cl– → Cl2
d. Cr2O72+ → CrO42-
e. H2O → H+
Soal nomor 22
Berikut ini yang merupakan reaksi redoks, yaitu ….
a. Ag+ + Cl– → AgCl
b. H+ + Cl- → HCl
c. NaOH + HCl → NaCl + H2O
d. CuO + 2H+ → Cu2+ + H2O
e. Cu2+ + Zn → Cu + Zn2+
Soal nomor 23
Berikut ini yang bukan merupakan reaksi redoks, yaitu ….
a. 2I– + Cl2 → I2 + 2Cl–
b. NaOH + HCl → NaCl + H2O
c. 2KI + Cl2 → I2 + 2KCl
d. FeO + CO → Fe + CO2
e. 2Pb + O2 → 2PbO
Soal nomor 24
Diketahui beberapa reaksi sebagai berikut.
(1) SO42- → S2-
(2) Cr2O72- → 2CrO42-
(3) Mg → Mg2+
(4) S2O32- → S4O62-
Berdasarkan reaksi diatas, maka reaksi oksidasi terjadi pada nomor ….
a. 3 dan 4
b. 1 dan 3
c. 2 dan 3
d. 1 dan 2
e. 2 dan 3
Soal nomor 25
Perhatikan reaksi redoks berikut!
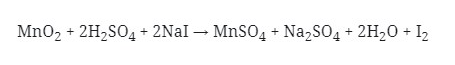
Berdasarkan redoks di atas, yang berperan sebagai oksidator, yaitu ….
a. NaI
b. H2SO4
c. Mn2+
d. I–
e. MnO2
Soal nomor 26
Perhatikan reaksi redoks di bawah ini!
Cl2(aq) + 2KOH(aq) → KCl(aq) + KClO(aq) + H2O(l)
Beradasarkan reaksi redoks di atas, unsur Cl terdapat diruas kanan dan kiri, sehingga dapat dilihat perubahan bilangan oksidasi unsur klor yang benar, yaitu dari .…
a. 0 ke -1 dan +1
b. 0 ke -1 dan -2
c. +1 ke 0
d. 0 ke +1 dan -11
e. +1 ke 0 dan -1
Soal nomor 27
Di dalam kehidupan sehari-hari banyak kejadian yang melibatkan reaksi redoks seperti berikut, kecuali .…
a. reaksi redoks pada pemutih pakaian
b. reaksi redoks pada penyetruman akumulator
c. reaksi redoks pada ekstraksi logam
d. reaksi redoks pada daur ulang perak
e. reaksi redoks pada pembuatan pelastik
Soal nomor 28
Berikut ini nama senyawa dengan rumus kimia Li2O yang tepat adalah ….
a. dilitium monoksida
b. dilitium oksida
c. litium oksida
d. litium (I) oksida
e. litium (II) oksida
Jawaban : c
Soal nomor 29
Nama senyawa yang tepat untuk Fe2O3, yaitu ….
a. Besi oksida
b. Dibesi trioksida
c. Besi dioksida
d. Besi (II) oksida
e. Besi (III) Oksida
Soal nomor 30
Berikut ini rumus kimia dari Timah (IV) klorida adalah ….
a. Sn4Cl
b. SnCl4
c. SnCl2
d. SnCl
e. Sn2Cl
Jawaban : b
Soal nomor 31
Berikut ini rumus kimia yang benar untuk aluminium fospat adalah ….
a. AlSO4
b. Al2(SO4)3
c. Al3(SO4)2
d. Al(SO4)2
e. Al(SO4)3
Soal nomor 32
Nama senyawa di bawah yang sesuai dengan rumus kimianya adalah ….
a. Na2O = natrium monoksida
b. AlCl3 = aluminium trioksida
c. Fe2O3 = besi (II) trioksida
d. CaCO3 = kalsium karbonat
e. Cu(NO3)2 = tembaga nitrat
Soal nomor 33
Nama yang benar untuk senyawa Fe2(SO4)3, yaitu ….
a. Besi sulfida
b. Besi sulfida
c. Besi (III) sulfat
d. Besi (II) sulfat
e. Besi sulfat
Soal nomor 34
Rumus kimia dari senyawa poliatom nitrogen trioksida, yaitu ….
a. NO
b. NO2
c. 2NO
d. N2O
e. NO3
Soal nomor 35
Perhatikan penamaan senyawa berikut!
1). N2O3 = dinitrogen trioksida
2). NO2 = nitrogen oksida
3). N2O5 = dinitrogen pentaoksida
4). N2O = nitrogen tetra oksida
5). NO = nitrogen dioksida
Tata nama senyawa yang benar terdapat pada nomor ….
a. 1) dan 2)
b. 1) dan 3)
c. 2) dan 3)
d. 2) dan 4)
e. 2) dan 5)
Soal nomor 36
Perhatikan tabel berikut!
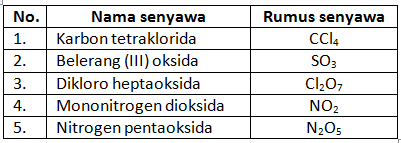
Pasangan nama senyawa dan rumus senyawa yang benar, yaitu ….
a. 1 dan 2
b. 2 dan 3
c. 1 dan 3
d. 3 dan 5
e. 4 dan 5
Soal nomor 37
Nama yang benar untuk senyawa HNO3 dan H3PO4 adalah ….
a. Asam klorida dan asam nitrit
b. Asam klorida dan asam sulfat
c. Asam posfat dan asam sulfat
d. Asam asetat dan asam cuka
e. Asam nitrat dan asam posfat
Soal nomor 38
Berikut ini nama yang benar untuk senyawa HCLO4, yaitu ….
a. asam perklorat
b. asam sulfat
c. asam klorat
d. asam klorin
e. asam klorida
Soal nomor 39
Nama senyawa yang benar untuk NaOH, yaitu ….
a. Natrium hidroksida
b. Mononatrium hidroksida
c. Natrium oksida
d. Natrium tetraoksida
e. Natrium hidrida
Soal nomor 40
Nama senyawa yang benar untuk Mg(OH)2 dan Al(OH)3 adalah ….
a. Mangan hidroksida dan aluminum hidroksida
b. Magnesium hidroksida dan aluminium hidroksida
c. Magnesium hidroksida dan alumunium trihidroksida
d.Mangan dioksida dan aluminuium trihidroksida
e. Magnesium hidroksida dan trialuminum hidroksida
Kunci jawaban : Unduh
Demikian yang dapat dibagikan mengenai soal PTS 2 Kimia kelas 10 SMA SMK Tahun 2023. Semoga bermanfaat.



