Latihan Soal Sifat Koligatif Larutan Kimia Kelas 12 SMA MA
Gurubagi.com. Berikut ini kami bagikan latihan soal sifat koligatif larutan kimia kelas 12 SMA MA Kurikulum 2013.
Latihan soal sifat koligatif larutan kimia kelas 12 SMA MA ini untuk membantu belajar peserta didik dalam memahami materi kimia tentang sifat koligatif larutan.
Bentuk latihan soal sifat koligatif larutankimia kelas 12 SMA MA ini adalah Pilihan Ganda dengan lima alternatif jawaban dan sudah tersedia kunci jawabannya yang dapat di unduh dengan mudah.
Soal nomor 1
Molalitas 20% b/b larutan H2SO4 dalam air adalah …. (Mr H2SO4 = 98)
A. 2,55
B. 2,45
C. 2,32
D. 2,25
E. 2,15
Soal nomor 2
Molaritas larutan HCl 1 molal dengan ρ= 1,25 gram/mL (Mr =36,5) adalah ….
A. 2,4
B. 2,0
C. 1,8
D. 1,4
E. 1,2
Soal nomor 3
Pernyataan yang tepat mengenai sifat koligatif larutan adalah ….
A. tekanan osmosis bukan sifat koligatif larutan
B. sifat koligatif larutan tergantung pada jenis zat terlarut
C. sifat koligatif larutan bergantung pada jumlah partikel zat terlaurut
D. salah satu sifat koligatif larutan adalah penurunan titik didih larutan
E. penurunan tekanan uap merupakan sifat koligatif yang tergantung pada jenis zat
Soal nomor 4
Perhatikan beberapa gambaran molekuler partikel tidak sebenarnya antara zat terlarut dan zat pelarut dalam suatu larutan berikut!

Larutan yang mempunyai tekanan uap paling besar ditunjukkan oleh gambar nomor ….
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
Baca :
- Sifat Koligatif Larutan Elektrolit, Soal, dan Pembahasannya
- Sifat Koligatif Larutan Nonelektrolit, Soal, dan Pembahasannya
Soal nomor 5
Fraksi mol air dalam suatu larutan pada suhu 20oC dengan tekanan uap jenuh air 24 mmHg adalah 0,4, maka pada suhu tersebut akan terjadi penurunan tekanan uap sebesar….
A. 4,8 mmHg
B. 10,6 mmHg
C. 12,6 mmHg
D. 14,4 mmHg
E. 16,4 mmHg
Soal nomor 6
Jika tekanan uap jenuh air pada suhu 250C adalah 23mmHg maka tekanan uap jenuh untuk larutan urea 10 % massa pada suhu yang sama adalah …. (Mr urea=60, Mr air = 18)
A. (23 x 0,17) : 5,17 mmHg
B. (23 x 5,17) : 5 mmHg
C. (23 x 5) : 5,17 mmHg
D. (23 x 5,7) : 5,17 mmHg
E. (23 x 5,17) : 5,17 mmHg
Soal nomor 7
Pada kosentrasi yang sama, larutan di bawah ini yang diprediksi mempunyai titik didih paling tinggi terdapat pada larutan ….
A. C6H12O6
B. CO(NH2)2
C. Ba(OH)2
D. NaCl
E. HCl
Soal nomor 8
Jika kenaikan titik didih 1 molal larutan urea 0,52ºC, pada konsentrasi yang sama kenaikan titik didih untuk larutan NaCl (α = 1) adalah ….
A. 1,04ºC
B. 1,28ºC
C. 1,56ºC
D. 2,08ºC
E. 3,72ºC
Soal nomor 9
Dalam kadaan normal titik didih larutan 1 molal larutan K2SO4 adalah 101,56oC. maka titik didih untuk larutan NaOH pada konsentrasi yang sama diprediksi ….
A. 100,52oC
B. 101,04oC
C. 101,56oC
D. 102,08oC
E. 103,72oC
Soal nomor 10
Pada konsentrasi yang sama dengan larutan gula; manakah larutan di bawah ini yang akan mempunyai kenaikan titik didihnya tiga kali lebih tinggi dari larutan gula adalah ….
A. NaCl (α = 1)
B. C6H12O6 (α=0)
C. CO(NH2)2 (α=0)
D. Mg(OH)2 (α = 0,75)
E. K2SO4 (α = 1)
Soal nomor 11
Di dalam keadaan normal, titik beku larutan urea dalam air pada konsentrasi tertentu -2oC , maka titik didihnya adalah …. (Kb= 0,520 C/m dan Kf = 1,860C/m)
A. 100,56oC
B. 100,62oC
C. 100,76oC
D. 101,08oC
E. 102,00oC
Soal nomor 12
Sebanyak 0,20 molal larutan gula dalam air, dalam keadaan normal mempunyai titik beku sama dengan ….
A. 0,05 molal larutan KOH (α =1)
B. 0,10 molal larutan HNO3 (α = 1)
C. 0,15 molal larutan CO(NH2)2 (α =0)
D. 0,25 molal larutan NaCl (α = 1)
E. 0,30 molal larutan HF (α =0,75)
Soal nomor 13
Perhatikan diagram PT di bawaah ini, daerah proses membeku larutan ditunjukkan oleh ….

A. KL
B. KS
C. LR
D. RM
E. SN
Soal nomor 14
Pada molalitas yang sama, larutan dengan titik beku paling rendah terdapat pada larutan ….
A. Mg(OH)2 (α = 0,25)
B. NaCl (α = 1)
C. HNO2 (α = 0,30)
D. AlCl3 (α = 0,75)
E. CO(NH2)2 (α = 0)
Soal nomor 15
Di dalam keadaan normal titik didih larutan NaCl dalam air pada konsentrasi tertentu 101,04ºC, maka titik bekunya adalah ….(Kf = 1,86ºC/m, Kb = 0,52ºC/m)
A. – 0,52ºC
B. – 1,04ºC
C. – 2,08ºC
D. – 3,72ºC
E. – 6,54ºC
Soal nomor 16
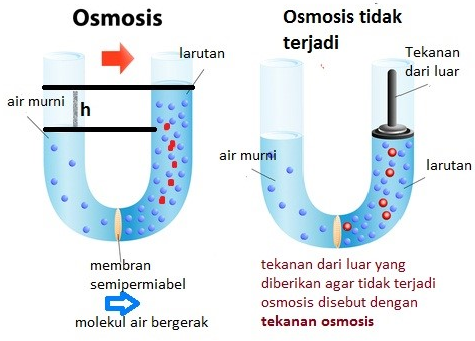
Pada konsentrasi yang sama dengan larutan urea, manakah larutan di bawah ini yang tekanan osmosisnya tiga kali lebih besar dari larutan urea ….
A. NaCl (α = 1)
B. K2SO4 (α = 1)
C. C6H12O6 (α = 0)
D. Fe2(SO4)3 (α = 0,75)
E. C12H22O11 (α = 0)
Soal nomor 17
Larutan yang isotonik dengan 0,3 M larutan glukosa pada temperatur yang sama adalah ….
A. 0,30 M NaCl (α = 1)
B. 0,20 M KOH (α = 1)
C. 0,15 M Na2SO4 (α = 1)
D. 0,10 M Al2(SO4)3 (α = 0,5)
E. 0,05 M HNO2 ( α = 0,75)
Soal nomor 18
Beberapa contoh penerapan sifat koligatif larutan dalam kehidupan sehari-hari adalah sebagai berikut.
(1) Proses penyerapan air dalam tanah oleh akar
(2) Membasmi lintah dengan garam dapur
(3) Pemakaian urea untuk mencairkan salju
(4) Penambahan glikol pada radiator mobil
Penerapan sifat koligatif yang berhubungan dengan tekanan osmotik ….
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Soal nomor 19
Contoh penerapan sifat koligatif dalam kehidupan sehari-hari yang dapat kita temui di antaranya sebagai berikut.
(1) Air radiator mobil dapat dicampur dengan etilen glikol; dan
(2) Larutan infus dimasukkan ke dalam tubuh pasien melalui pembuluh darah.
Sifat koligatif yang terdapat dalam contoh tersebut secara berurutan adalah ….
A. penurunan tekanan uap jenuh dan penurunan titik beku
B. penurunan tekanan uap jenuh dan kenaikan titik didih
C. penurunan titik beku dan kenaikan titik didih
D. penurunan titik beku dan tekanan osmosis
E. tekanan osmosis dan penurunan tekanan uap jenuh
Soal nomor 20
Jika 5 gram protein dilarutkan ke dalam air hingga volume larutan 500 mL sehingga pada suhu 27ºC tekanan osmotik larutan 0,012 atm. Berdasarkan pada data tersebut, massa rumus protein dapat ditentukan sebesar …. ( R = 0,082 )
A. 25.000
B. 20.000
C. 20.100
D. 20.300
E. 20.500
Kunci Jawaban – Unduh
Demikian yang dapat kami bagikan mengenai latihan soal sifat koligatif kimia kelas 12 SMA MA. Semoga bermanfaat.



g bisa diunduh🗿🗿
Terimaksih bnyk atas koreksinya…sudah diperbaiki, silahkan unduh
Soal bisa langsung di copas ke word…kunci jawaban juga bisa di unduh.
terima kasih
sama2