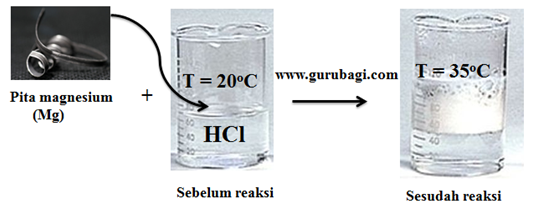
Latihan Soal Termokimia Kelas 11 SMA MA dan Kunci Jawaban
Gurubagi.com. Berikut ini kami bagikan latihan soal materi termokimia kelas 11 SMA MA Kurikulum 2013.
Latihan soal materi termokimia kelas 11 SMA MA ini untuk membantu belajar peserta didik dalam memahami materi kimia tentang termokimia.
Bentuk latihan soal materi minyak bumi kelas 11 SMA/MA ini adalah Pilihan Ganda dengan lima alternatif jawaban dan sudah tersedia kunci jawabannya yang dapat di unduh dengan mudah
Soal nomor 1
Ciri-ciri reaksi eksoterm adalah ….
A. lingkungan menyerap kalor dari sistem
B. sistem menyerap kalor dari ingkungan
C. sistem dan lingkungan memiliki kalor sama
D. kalor sistem dan lingkungan jika dijumlahkan sama dengan nol
E. pada akhir reaksi, kalor lingkungan selalu lebih kecil dari kalor system
Soal nomor 2
Sebanyak 2 mol gas hidrogen jika direaksikan dengan 1 mol gas oksigen akan terbentuk uap air yang membutuhkan kalor sebesar 484 kJ. Persamaan termokimianya adalah ….
A. H2(g) + ½ O2(g) –> H2O(g) ΔH = 484 kJ
B. 2 H2(g) + O2(g) –> 2 H2O(g) ΔH = 484 kJ
C. 2 H2(g) + O2(g) –> 2 H2O(g) ΔH = –484 kJ
D. 2 H2O(g) –> 2 H2(g) + O2(g) ΔH = –484 kJ
E. H2O(g) –> H2(g) + ½ O2(g) ΔH = 484 kJ
Soal nomor 3
Pernyataan yang benar tentang reaksi endoterm, yaitu ….
A. sistem melepaskan kalor
B. ∆H < 0
C. entalpi produk lebih kecil daripada entalpi reaktan
D. entalpi sistem bertambah
E. entalpi sistem tetap
Soal nomor 4
Persamaan reaksi termokimia berikut yang merupakan reaksi penguraian standar adalah ….
A. H2 + ½ O2 → H2O ∆H = -242 kJ
B. CO2 → CO + ½ O2 ∆H = +283 kJ
C. LiOH → Li+ + OH- ∆H = -20 kJ
D. NH3 → N2 + 3/2 H2 ∆H = +92 kJ
E. H2 + O2 → H2O ∆H = -242 kJ
Soal nomor 5
Diketahui reaksi: 2HCl(g) –> H2(g) + Cl2(g) DH = +184 kJ, maka perubahan entalpi pada pembentukan 1 mol HCl adalah …
A. + 230 kJ
B. + 184 kJ
C. + 92 kJ
D. – 92 kJ
E. -100 kJ
Soal nomor 6
Berikut ini pernyataan yang benar mengenai proses endoterm adalah ….
A. entalpi sistem berkurang dan ΔH bernilai positif
B. entalpi sistem berkurang dan ΔH bernilai negatif
C. entalpi sistem bertambah dan ΔH bernilai positif
D. entalpi lingkungan berkurang dan ΔH bernilai negatif
E. entalpi lingkungan tetap dan ΔH bernilai negatif
Soal nomor 7
Perhatikan gambar di bawah ini!
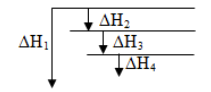
Berdasarkan diagram di atas, maka nilai ΔH2 adalah …
A. ΔH1 + ΔH3 + ΔH4
B. ΔH1 – ΔH3 – ΔH4
C. ΔH1 + ΔH3 + Δ H4
D. ΔH1 +ΔH3 – ΔH4
Soal nomor 8
Perhatikan diagram berikut!

Berdasarkan hukum Hess, maka nilai x adalah …
A. +91 kJ
B. -23 kJ
C. +23 kJ
D. -91 kJ
E. -20 kJ
Soal nomor 9
Diketahui:
2H2 + O2 –> 2H2O ΔH = – 571 kJ/mol
2Ca + O2 –> 2CaO ΔH = – 1269 kJ/mol
CaO + H2O –> Ca(OH)2 ΔH = – 64 kJ/mol
Besar ΔH untuk reaksi penguraian Ca(OH)2 adalah …
A. + 984 kJ/mol
B. + 1161 kJ/mol
C. + 1452 kJ/mol
D. + 1966 kJ/mol
E. + 100 kJ/mol
Soal nomor 10
Perhatikan reaksi berikut!
NO + O2 → NO2
Reaksi tersebut adalah reaksi ….
A. pembentukan NO2
B. pembentukan NO
C. pembakaran NO
D. pembakaran NO2
E. pembakaran O2
Soal nomor 11
Perhatikan gambar berikut!

Terjadinya reaksi endoterm ditunjakkan pada gambar nomor…
A. 1 dan 3
B. 2 dan 4
C. 1 dan 4
D. 1 dan 2
E. 3 dan 4
Soal nomor 12
Diketahui :
ΔHof C2H6(g) = -84,7 kJ/mol
ΔHof H2O (l) = -285,8kJ/mol
ΔHof CO2(g) = -393,6 kJ/mol
Berdasarkan data entalpi pembentukan standar tersebut, maka besar perubahan entalpi pembakaran gas etana adalah ,….
A. -84,7 kJ/mol
B. -285,8 kJ/mol
C. -393,5 kJ/mol
D. -1559,7 kJ/mol
E. -1644,4 kJ/mol
Soal nomor 13
Perhatikan persamaan termokimia berikut!
2CuCl(s) → 2Cu(s) + Cl2(g) ΔH = +274,4 kJ
2CuCl(s) + Cl2(g) → 2CuCl2(s) ΔH= -165,8 kJ
ΔH untuk reaksi :Cu(s) + Cl2(g) → CuCl2(s) adalah ….
A. 43 kJ/mol
B. 86 kJ/mol
C. 484 kJ/mol
D. 570 kJ/mol
E. 1054 kJ/mol
Soal nomor 14
Data energi ikatan rata rata :
C = C = 609 kJ/mol
C – Cl = 326 kJ/mol
C – H = 412 kJ/mol
C – C = 345 kJ/mol
H – Cl = 426 kJ/mol
Besarnya entalpi reaksi CH2=CH2 + HCl → CH3CH2Cl adalah …..
A. -312 kJ/mol
B. -48 kJ/mol
C. 48 kJ/mol
D. 100 kJ/mol
E. 312 kJ/mol
Soal nomor 15
Diketahui :
CS2 + 3O2 → CO2 + 2SO2 ΔH = -1110 kJ
CO2 → C + O2 ΔH = +394 kJ
SO2 → S + O2 ΔH = +297 kJ
maka kalor pembentukan CS2 adalah ….
A. +122 kJ
B. -122 kJ
C. +419 kJ
D. -419 kJ
E. +906 kJ
Soal nomor 16
Diketahui persamaan termokimia pembentukan Fe2O3 dan CO2:
2Fe(s) + 3/2O2(g) → Fe2O3(s) H = – 822 kJ/mol
C(s) + 1/2O2(g) → CO(g) H = -110 kJ/mol
Perubahan entalpi untuk reaksi : Fe2O3(s) + 3C(g) → 2Fe(s) + 3CO(g) H adalah …. kJ/mol
A. + 712
B. +492
C. -492
D. -712
Soal nomor 17
Reaksi termokimia : S (s) + O2(g) => SO2(g) ΔH = -y kJ Pernyataan berikut yang tidak benar adalah …. (Ar S = 32)
A. ΔH pembentukan SO2 = -y kJ
B. ΔH pembakaran S = -y kJ
C. ΔH penguraian SO2 = +y kJ
D. pada pembentukan 2 mol SO2 dibebaskan kalor sebesar y kJ
E. pada pembakaran 16 gram S dibebaskan kalor sebesar ½y kJ
Soal nomor 18
Diketahui:
2H2 + O2 —> 2H2O ΔH = – 571 kJ/mol
2Ca + O2 —> 2CaO ΔH = – 1269 kJ/mol
CaO + H2O —> Ca(OH)2 ΔH = – 64kJ/mol
Besar ΔH untuk reaksi penguraian Ca(OH)2 adalah ….
A. + 984 kJ/mol
B. + 1161 kJ/mol
C. + 1452 kJ/mol
D. + 1966 kJ/mol
E. -1500 kJ/mol
Soal nomor 19
Berikut ini yang merupakan reaksi pembentukan standar adalah ….
A. Ca(s) + O(g) + H(g) ——> Ca(OH)2 (s) ΔH = -a kal
B. Ca2+(s) + O2 (g) + H2(g) ——> Ca(OH)2 (s) ΔH = -a kal
C. Ca(s) + O2 (g) + H2(g) ——> Ca(OH)2 (s) ΔH = -a kal
D. Ca(s) + 2O2(g) + 2H(g) ——> Ca(OH)2 (s) ΔH = -a kal
E. 2Ca(s) + O2(g) + H2(g) ——> 2Ca(OH)2 (s) ΔH = -a kal
Soal nomor 20
Jika kalor jenis air adalah 4,18 J.g-1.ºC, maka untuk memanaskan 50 gram air dari suhu 25ºC menjadi 75ºC memerlukan kalor sebesar ….
A. 8,250 kJ
B. 9,725 kJ
C. 10,450 kJ
D. 11,725 kJ
E. 12,45 kJ
Kunci Jawaban – Unduh
Demikian yang dapat kami bagikan mengenai latihan soal termokimia kelas 11 SMA MA Kurikulum 2013. Semoga bermanfaat