Materi Stoikiometri Kelas 10 SMA SMK : Hukum Dasar Kimia
Gurubagi.com. Di dalam materi stoikiometri terdapat beberapa hukum dasar Kimia, sebelum mempelajari aspek kuantitatif dan kualitatif ilmu kimia secara keseluruhan.
Hukum dasar Kimia adalah teori yang merumuskan fakta-fakta empiris dari berbagai observasi dan eksperimen kimia berulang-ulang dengan menggunakan metode ilmiah. Hukum tersebut berasal dari berbagai percobaan sehingga kebenarannya dapat terbukti.
Baca : Tata Nama Senyawa Anorganik dan Organik Serta Contoh Soalnya
Hukum Dasar Kimia
Berikut ini adalah hukum dasar kimia yang terdapat pada materi stoikiometri.
1. Hukum Lavoiser (Kekekalan Massa)
Hukum Lavoisier ini dicetuskan oleh ilmuwan asal Prancis, yaitu Antonie Laurent Lavoisier(1743-1794).
Lavoisier melakukan penelitian dengan membakar merkuri cair berwarna putih dengan Oksigen sampai dihasilkan merkuri oksida berwarna merah.
Hasil penelitian menunjukan bahwa massa Oksigen pada proses pembakaran sama dengan massa Oksigen yang terbentuk setelah merkuri oksida dipanaskan.
Oleh karena itu, hukum Lavoisier dikenal sebagai hukum kekekalan massa. Adapun pernyataan hukum Lavoisier adalah sebagai berikut.
“Massa zat sebelum reaksi sama dengan massa zat setelah reaksi.”
2. Hukum Proust (Ketetapan Perbandingan)
Seorang ilmuwan asal Prancis, Joseph Louis Proust (1755-1826), meneliti perbandingan massa unsur yang terkandung di dalam suatu senyawa.
Joseph Louis Proust melakukan eksperimen dengan mereaksikan unsur hidrogen dan unsur oksigen. Proust menemukan bahwa unsur hidrogen dan unsur oksigen selalu bereaksi membentuk senyawa air dengan perbandingan massa yang tetap, yaitu 1 : 8.
Berikut ini adalah tabel hasil percobaan Proust.
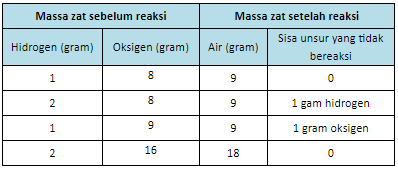
Penelitian itu membuktikan bahwa setiap senyawa tersusun atas unsur-unsur dengan komposisi tertentu dan tetap. Oleh karena itu, hukum Proust dikenal sebagai hukum perbandingan tetap.
Berikut ini adalah pernyataan hukum Proust.
Suatu senyawa perbandingan massa unsur-unsur penyusun selalu tetap tinggi.
3. Hukum Dalton (Perbandingan Berganda)
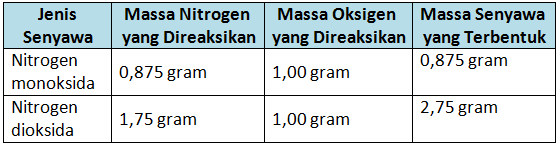
Dengan massa oksigen yang sama, ternyata perbandingan massa nitrogen dalam senyawa nitrogen dioksida dan senyawa nitrogen monoksida merupakan bilangan bulat dan sederhana.
Perbandingannya adalah sebagai berikut.

Hukum ini berkaitan dengan pasangan senyawa unsur yang dapat membentuk lebih dari satu jenis senuyawa.
Bunyi dari hukum Dalton ini adalah:
Perbandingan massa unsur-unsur dalam sejumlah senyawa senyawa merupakan bilangan bulat sederhana.
4. Hukum Gay Lussac (Perbandingan Volume)
Hukum Gay Lussac berasal dari ilmuan Prancis, yaitu Joseph Gay Lussac (1805). Lussac meneliti tentang volume gas dalam suatu reaksi kimia.
Berdasarkan penelitiannya, Lusac mengambil kesimpulan bahwa perubahan suhu dan tekan berpengaruh terhadap volume gas.
Pada suhu dan tekanan tertentu, 1 liter gas nitrogen bisa bereaksi dengan 3 liter gas Hidrogen menghasilkan 2 liter gas amonia.
Adapun persamaan reaksinya adalah sebagai berikut.
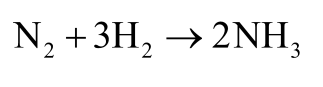
Berikut ini adalah pernyataan hukum Gay Lussac.
Volume gas-gas yang bereaksi dengan volume gas-gas hasil reaksi akan berbanding sebagai bilangan (koefisien) bulat sederhana jika diukur pada suhu dan tekanan yang sama.
5. Hukum Avogadro
Hipotesis Avogadro berasal dari seorang ilmuwan asal Italia, Amadeo Avogadro, pada tahun 1811. Avogadro menyatakan bahwa partikel unsur tidak selalu berupa atom yang berdiri sendiri, melainkan bisa berbentuk molekul unsur, contohnya H2, O2, N2, dan P4.
Berdasarkan pemikiran tersebut, Avogadro berhasil menjelaskan hukum Gay Lussac dan membuat hipotesis sebagai berikut
Gas-gas dalam volume sama akan mempunyai jumlah molekul yang sama jika diukur pada suhu dan tekanan yang sama.
Dengan adanya hipotesis tersebut, menyatakan bahwa perbandingan volume gas sama dengan perbandingan koefisien, dengan rumus matematis sebagai berikut.
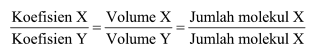
Penerapan Soal Hukum Dasar Kimia
1. Hukum Lavoisier
Kawat tembaga dibakar dalam pembakaran bunsen sehingga terbentuk tembaga oksida (CuO). Persamaan reaksinya adalah sebagai berikut.
2Cu(s) + O2(g) → 2CuO(s)
Jika berat Cu semula adalah 32 g dan CuO yang terbentuk 40 g, berapakah berat O2 yang bereaksi?
Jawab :
Menurut Hukum Kekekalan Massa, dalam reaksi kimia tidak terjadi perubahan massa. Oleh karena itu, berat O2 yang bereaksi adalah 40 g – 32 g = 8 g.
32 g Cu(s) + 8 g O2(g) → 40 g CuO(s)
2. Hukum Proust
Senyawa karbon dioksida terbentuk dari unsur karbon dan Oksigen dengan perbandingan massa karbon dan Oksigen adalah 3 : 8.
Jika unsur karbon yang bereaksi 1,5 gram, tentukan massa Oksigen yang bereaksi dan massa karbon dioksida yang terbentuk!
Jawab :
Dari soal tersebut diketahui:


Jadi, massa Oksigen yang bereaksi dan massa karbon dioksida yang terbentuk berturut-turut adalah 4 gram dan 5,5 gram.
3. Hukum Dalton
Perbandingan massa N dan O dalam senyawa NO dan NO2 adalah sebagai berikut.
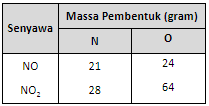
Buktikan apakah kedua rumus senyawa tersebut memenuhi Hukum Kelipatan Perbandingan?
Jawab :
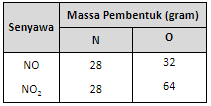
Dari perbandingan ini, untuk perbandingan massa N yang sama ternyata perbandingan massa oksigennya 32 : 64 atau 1 : 2 yang merupakan bilangan bulat dan sederhana. Dengan demikian, kedua rumus tersebut telah memenuhi Hukum Kelipatan Perbandingan.
4. Hukum Gay Lussac
Berapa liter gas oksigen untuk membakar 5 liter gas butana (C4H10) agar semua gas butana tersebut habis bereaksi?
Jawab :
Reaksi yang terjadi adalah
![]()
Setarakan reaksi :
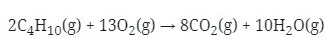
Menurut hukum Gay-Lussac : perbandingan volume = perbandingan koefisien. Untuk mencari volume gas oksigen melalui perbandingan koefisien dengan gas butana.
Koefisien C4H10 : koefisien O2 = volume C4H10 : volume O2
2 : 13 = 5 : volume O2
Maka volume O2 = 13/2 x 5 liter = 32,5 Liter.
5. Hukum Avogadro
Jika 5 liter gas hidrogen pada suhu dan tekanan yang sama jumlah molekulnya 3n, maka tentukan :
a. volume gas CO2 yang mengandung 6n buah molekul CO2!
b. jumlah molekul dari 15 liter gas oksigen!
Jawab :
Volume CO2
= (jumlah molekul CO2/jumlah molekul H2) × volume H2
= (6n/3n) × 5 liter = 10 liter
Jumlah molekul O2
= (volume O2/volume H2) × jumlah molekul H2
= (15/5) × 3n = 9n buah molekul
Demikian sekilas penjelasan materi stoikiometri kelas 10 SMA/SMK tentang hukum dasar Kimia. Semoga bermanfaat