Materi Stoikiometri : Konsep Mol Beserta Penerapan Soalnya
Gurubagi,com. Mol merupakan unit dasar yang digunakan dalam sistem Satuan Internasional (SI), sehingga secara internasional perhitungan untuk mengukur jumlah zat menggunakan satuan mol.
Konsep mol dapat diterapkan untuk berbagai situasi, berguna dalam menentukan berapa massa zat yang akan direaksikan, sehingga jumlahnya setara dan efisien untuk bereaksi.
Baca : Soal Tata Nama Senyawa Kelas 10 SMA SMK Dilengkapi Pembahasannya
Di dalam suatu reaksi, jumlah mol sangat menentukan reaksi terutama untuk menentukan produk yang akan terbentuk.
Sebagai contoh, untuk membentuk produk H2O dalam suatu reaksi membutuhkan sebanyak 2 mol hidrogen dan 1 mol oksigen.
Ketika jumlah tersebut tidak terpenuhi, maka H2O juga tidak akan terbentuk. Itulah mengapa konsep mol ini sangat menentukan reaksi kimia.
Perhitungan Konsep Mol
1. Hubungan Mol Dengan Massa Zat
Untuk memahami pengertian massa molar zat, perhatikan data dalam tabel berikut ini.


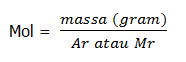
Massa = Mol x Ar atau Mr
Keterangan:
Penerapan Soal Hubungan Mol Dengan Massa Zat
a. Tentukan jumlah mol senyawa NaCl 106 gram, jika Ar Na = 23 dan Ar Cl = 35!
Pembahasan:
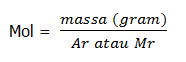
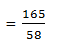
= 1,8 mol
b. Tentukan massa dari 0,1 mol CO(NH2)2, jika Ar C =12, san Ar N = 14, Ar H =1.
Pembahasan:
Massa = mol x Mr
Mr CO(NH2)2 = 1.ArC + 2.Ar N + 4.Ar H
= 1.12 + 2.14 + 4.1
= 60
Massa = 0,1 x 60
Massa = 6 gram
2. Hubungan Mol Dengan Jumlah Partikel
Untuk mengetahui hubungan antara mol dengan jumlah partikel beberapa zat, coba perhatikan tabel berikut ini.
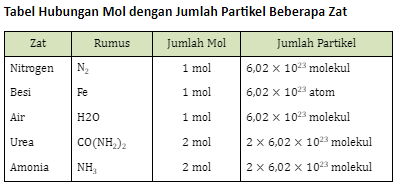
Sesuai data tabel tersebut, 1 mol unsur mengandung 6,02 × 1023 atom dan 1 mol senyawa mengandung 6,02 × 1023 molekul, sehingga dapat kita simpulkan bahwa:
![]()
Para ahli kimia menetapkan bahwa satu mol zat mengandung partikel zat sebanyak yang terdapat dalam 12 gram atom karbon–12.
Berdasarkan percobaan dapat diketahui bahwa dalam 12 gram atom C–12 terdapat 6,02 × 1023 atom karbon terkenal sebagai tetapan Avogadro dengan lambang N.
Penerapan Soal Hubungan Mol Dengan Jumlah Partikel
Terdapat 10 mol senyawa MgCl2.
- Sebutkan jenis partikel senyawa MgCl2!
- Berapa jumlah partikel senyawa dalam sampel tersebut?
Pembahasan :
MgCl2 adalah senyawa ion dengan partikel berupa ion Mg2+dan ion Cl–.
Jumlah partikel berupa ion Mg2+dan ion Cl–dalam 10 mol MgCl2 adalah sebagai berikut.
1 mol MgCl2 mengandung 1 mol Mg2+ dan 2 mol Cl–, sehingga 10 mol MgCl2 mengandung 10 mol Mg2+ dan 20 mol Cl–.
Jumlah partikel masing-masing ion dapat kita hitung dengan cara berikut.
- ion Mg2+
Jumlah partikel = mol × N
= 10 mol × 6,02 × 1023 partikel/mol
= 6,02 × 1024 partikel (ion)
- ion Cl–
Jumlah partikel = mol × N
= 20 mol × 6,02 × 1023 partikel
= 1,204 × 1025 partikel
Jadi, dalam 10 mol senyawa MgCl2 mengandung 6,02 × 1024 ion Mg2+ dan 1,204 × 1025 ion Cl–.
3. Hubungan Mol Dengan Volume
a. Konsep Mol pada STP
Di dala mkondisi standar dengan suhu 0oC dan tekanan 1 atm, maka disebut pada keadaan STP (Standard Temperature and Pressure). Pada keadaan STP, 1 mol gas setara dengan 22,4 Liter, sehingga:
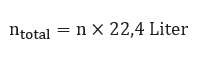
Untuk mengetahui jumlah mol suatu molekul, maka bisa menggunakan rumus:
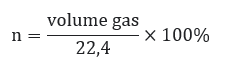
b. Penerapan Soal Konsep Mol pasa STP
Hitung massa dari 4,48 liter gas C2H2 yang diukur pada keadaan standar!
Pembahasan:
Kuantitas (dalam mol) C2H2
Volume =
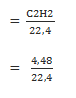
= 0,2 mol
Jadi massa C2H2 = mol x Massa molar C2H2
= 0,2 mol x 26 gram/mol
= 5,2 gram
c. Konsep Mol Pada Gas Ideal
Pada kondisi gas ideal, maka dapat menggunakan rumus:
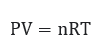
Dengan demikian, maka untuk mencari mol menggunakan rumus:
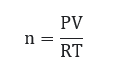
Keterangan:
P : tekanan (atm)
V : volume (liter)
n : mol
R : tetapan gas ideal 0,08205 atm.L/mol.K
T : suhu (kelvin)
Penerapan Soal Konsep Pada Gas Ideal
Tentukan volume 1,7 gram gas amonia yang diukur pada suhu 27 °C dan tekanan 76 cmHg!
Pembahasan:
n = massa amonia / massa molar amonia
= 1,7 gram / 17 gram/mol
= 0,1 mol
P = (76 cmHg / 76 cmHg) x 1 atm = 1 atm
T = (t + 273) K = 27 + 273 = 300 K
P V = n R T
1 atm × V = 0,1 mol × 0,082 L atm / mol K × 300 K
V = 2,46 L
Demikian sekilas pembahasan tentang materi stoikiometri : konsep mol beserta penerapan soalnya. Semoga bermanfaat.