Materi Stoikiometri : Persamaan Reaksi, Contoh Soal, dan Pembahasannya
Gurubagi.com. Persamaan reaksi merupakan penulisan reaksi dengan menyatakan lambang unsur atau rumus kimia yang terlibat dalam reaksi kimia, terdiri atas zat-zat pereaksi dan zat-zat hasil reaksi disertai koefisien dan fasa masing-masing
Perubahan yang terjadi dalam suatu reaksi dapat kita jabarkan dengan menggunakan rumus kimia zat-zat yang terlibat dalam reaksi, sedangkan cara penajabarannya disebut dengan persamaan reaksi. Persamaan reaksi termasuk dalam materi stoikiometri
Penyetaraan persamaan reaksi merupakan penerapan hukum kekekalan massa dan Teori Atom Dalton, yang berbunyi bahwa massa unsur sebelum dan sesudah reaksi adalah sama.
Persamaan reaksi menggambarkan rumus kimia zat-zat pereaksi (reaktan) yang berada sebelah kiri anak panah dan zat-zat hasil reaksi (produk), yang berada pada sebelah kanan anak panah.
Wujud zat-zat yang terdapat dalam persamaan reaksi, baik pereaksi dan hasil reaksi ada empat macam, yaitu gas (g), cairan (liquid atau l), zat padat (solid atau s) dan larutan (aqueous atau aq).
Bilangan yang mendahului rumus kimia zat-zat dalam persamaan reaksi disebut koefisien reaksi. Koefisien reaksi dapat berfungsi untuk menyetarakan atom-atom sebelum dan sesudah reaksi.
Baca :
- Stoikiometri : Massa Atom Relatif (Ar) dan Massa Molekul Relatif (Mr)
- Materi Stoikiometri Kelas 10 SMA SMK : Hukum Dasar Kimia
- Stoikiometri : Kadar Zat dalam Campuran, Rumus, dan Penerapan Soal
- Materi Stoikiometri : Konsep Mol Beserta Penerapan Soalnya
Menuliskan Persamaan Reaksi
Berikut ini adalah langkah-langkah penulisan persamaan reaksi.
1. Menuliskan persamaan yang berasal dari kata-kata dari nama dan wujud zat semua pereaksi beserta hasil reaksi.
2. Menerjemahkan persamaan kata-kata tersebut ke dalam persamaan rumus kimia.
3. Menyetarakan persamaan dengan koefisien (angka sebelum unsur) masing-masig senyawa yang sesuai
Contoh :
Natrium hidroksida bereaksi dengan asam sulfat mengahsilkan natriumsulfat dan air.
1. Persamaan kata-kata : Natrium hidroksida + asam sulfat menjadi natrium sulfat + air.
2. Persamaan rumus kimia : NaOH + H2SO4 → Na2SO4 + H2O.
3. Persamaan reaksi setara : 2NaOH + H2SO4 → Na2SO4 + 2H2O
Persamaan reaksi dapat kita katakan sudah setara jka jumlah unsur masing-masing yang berada ruas kiri (pereaksi) sama dengan jumlah unsur yang berada pada ruas kanan (hasil peraksi).
Jika jumlah atom sebelum dan sesudah reaksi belum setara, maka perlu mneyetarakan reaksi dengan cara menambahkan angka koefien pada bagian depan unsur yang kita anggap dapat membuat reaksi menjadi setara.
Penyetaraan reaksi ini hanya mengubah angka koefisien tanpa mengubah angka indek (angka yang kecil di bawah kanan unsur).
Penyetaraan Reaksi
Berikut adalah langkah-langkh penyetaraan reaksi secara umum.
1. Menuliskan persamaan kerangngka, yaitu persamaan reaksi yang belum setara dengan reaktan pada ruas kiri dan hasil reaksi pada ruas kanan
2. Menetapkan koefisien zat yang paling kompleks sama dengan 1
3. Setarakan dahulu unsur yang terkait langsung dengan zat yang kita beri koefien 1 tersebut.
4. Setarakan reaksi dengan mengatur koefisien reaktan dan hasil reaksi yang lain.
Contoh penerapan :
Setarakan reaksi berikut!
Al(s) + H2SO4(aq) → Al2(SO4)3(aq) + 3H2(g)
Pembahasan:
Strategi : menggunakan langkah-langkah penyetaraan persaman reaksi.
1. Persamaan kerangka
Al(s) + H2SO4(aq) → Al2(SO4)3(aq) + 3H2(g)
2. Koefisien zat paling kompleks sama dengan 1
Al2(SO4)3 = 1
3. Unsur yang berkaitan dengan Al2(SO4)3 adalah Al, S dan O
Menyetarakan atom Al :
Atom Al ruak kiri = 1, Atom Al ruas kanan = 2
Atom Al kanan =2, berasal dari angka koefisien Al ruas kanan 1 kali angka indek Al ruas kanan 2, sehingga banyaknya Al pada ruas kanan adalah 2. Agar ruas kiri sma maka koefisien Al ruas kiri diberi angka 2
2Al(s) + H2SO4(aq) → 1Al2(SO4)3(aq) + H2(g)
Menyetarakan atom S :
Atom S ruas kanan = 3, Atom S ruas kiri =1, sehingga atom S ruas kiri kita kasih angka koefisien 3
2Al(s) + 3H2SO4(aq) → 1Al2(SO4)3(aq) + H2(g)
Menyetarakan O :
Atom O ruas kanan adalah 4 x 3 = 12
Atom O ruas kiri adalah 3 x 4 = 12, berarti atom o ruas kiri dan kanan sudah sama
Menyetarakan unsur yang tidak terkait dengan Al, yaitu atom H.
Atom H ruas kanan = 2
Atom H ruas kiri = 6
Jumlah atom H ruas kiri dan kanan tidak sama agar sama maka atom H pada ruas kanan kita kasih angka koefisien 3.
2Al(s) + 3H2SO4(aq) → 1Al2(SO4)3(aq) + 3H2(g) (reaksi sudah setara)
Atau kita dapat menngunakan cara yang lebih mudahmelalui cara tabel berikut.
Strategi : menggunakan langkah-langkah penyetaraan persaman reaksi.
Langkah 1
Al(s) + H2SO4(aq) → Al2(SO4)3(aq) + H2(g)
Langkah 2
Penyetaraan
Koefisien zat paling kompleks beri angka koefisien 1, yaitu Al2(SO4)3 = 1 untuk zat-zat lain yang belum diketahui dapat menggunakan pemisalan dengan variabel, seperti berikut ini.
aAl(s) + bH2SO4(aq) → 1Al2(SO4)3(aq) + cH2(g)

Soal dan Pembahasan
Soal Nomor 1
Tuliskan dan setarakan persamaan reaksi antara logam aluminium dengan larutan asam klorida membentuk larutan aluminium klorida dan gas hidrogen.
Pembahasan:
Langkah 1
Menuliskan rumus kimia dan persamaan reaksi
Al(s) + HCl(aq) → AlCl3(aq) + H2(g)
Langkah 2
Penyetaraan:
a. Tetapkan koefisien AlCl3 = 1, sedangkan koefisien zat-zat lainnya dimisalkan dengan huruf atau variabel. a Al(s) + b HCl(aq) → 1 AlCl3(aq) + c H2(g)
b. Setarakan jumlah Al dan Cl
c. Setarakan jumlah Al dan Al C

Masukkan a dan b pada persamaan reaksi, sehingga persamaan reaksi menjadi: 1 Al(s) + 3 HCl(aq) → 1 AlCl3(aq) + c H2(g)
d. Setarakan jumlah atom H.
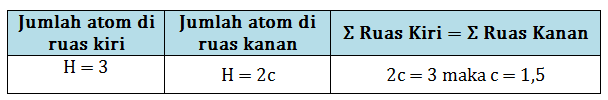
Masukkan koefisien c, sehingga persamaan reaksinya menjadi:
1 Al(s) + 3 HCl(aq) → 1 AlCl3(aq) + 1,5 H2(g)
Karena koefisien tidak boleh mengandung pecahan, maka untuk membulatkan pecahan, semua koefisien dikalikan dua, sehingga persamaannya menjadi:
2Al(s) + 6HCl(aq) → 2AlCl3(aq) + 3H2(g).
Soal nomor 2
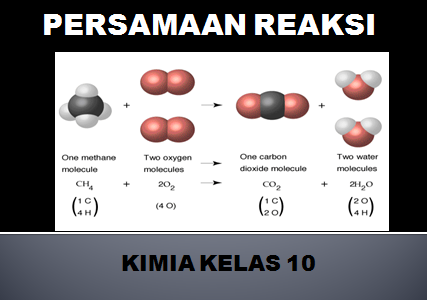
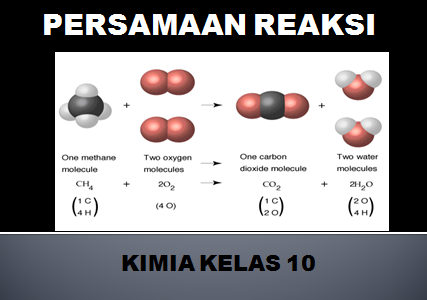
Tuliskan dan setarakan persamaan reaksi antara gas metana (CH4) dengan gas oksigen membentuk gas karbon dioksida dan uap air!
Pembahasan:
Langkah 1
Menuliskan rumus kimia dan persamaan reaksi
CH4(g) + O2(g) → CO2(g) + H2O(l)
Langkah 2
Penyetaraan:
a. Tetapkan koefisien CH4= 1, sedangkan koefisien zat-zat lainnya dimisalkan dengan huruf atau variabel.
1 CH4(g) + a O2(g) → b CO2(g) + c H2O(l)
b. Setarakan jumlah atom C dan H.
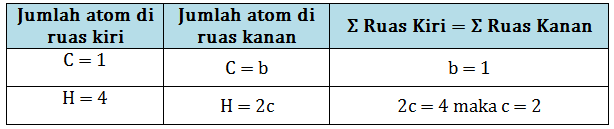
c. kita masukkan koefisien b dan c, sehingga persamaan reaksi menjadi :
1 CH4(g) + a O2(g) → 1 CO2(g) + 2 H2O(l)
d. kita setarakan jumlah atom O.

e. persamaan reaksi setara selengkapnya adalah:
1 CH4(g) + 2 O2(g) → 1 CO2(g) + 2 H2O(l)
Untuk selanjutnya, koefisien 1 tidak perlu ditulis, sehingga persamaan reaksinya menjadi:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
Demikian materi stoikiometri tentang persamaan reaksi, contoh soal dan pembahasannya. Semoga bermanfaat.