Pengertian Persamaan Reaksi dan Cara Menyetarakannya
Gurubagi.com. Persamaan reaksi menggambarkan reaksi kimia yang terdiri atas rumus kimia pereaksi dan hasil reaksi disertai koefiseinnya masing-masing.
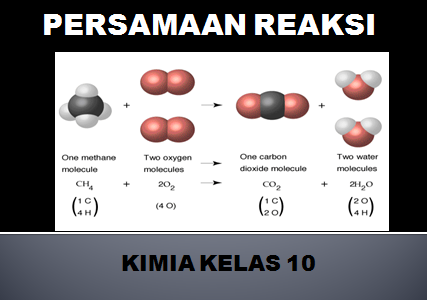
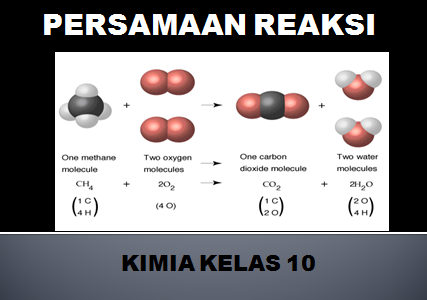
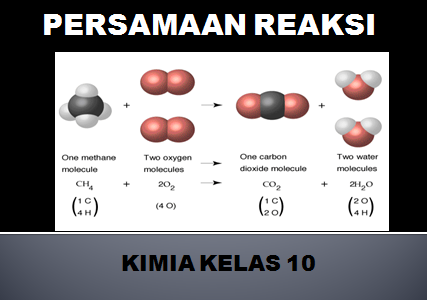
Persamaan reaksi kimia adalah pernyataan yang ditulis dengan rumus kimia yang memberikan informasi identitas dan kuantitas zat-zat yang terlibat dalam suatu perubahan kimia atau fsika.
Zat yang terlibat dalam persamaan reaksi ada yang jumlahnya berkurang setelah reaksi disebut dengan pereaksi (reaktan), berada di sebelah kiri tanda panah.
Sedangkan zat yang terdapat pada sebelah tanda panah merupakan hasil reaksi atau (produk), yaitu semua zat yang dihasilkan dari reaksi.
Perhatikan contoh berikut ini!
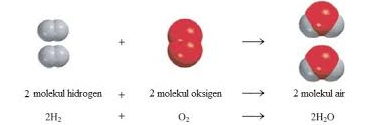
2H2(g) + O2(g) → 2H2O(l)
Jika zat memiliki koefisien 1, maka tidak perlu ditulis, sedangkan huruf cetak miring dalam tanda kurung yang mengikuti rumus kimia tiap-tiap zat menyatakan wujud zat yang besangkutan, yaitu
- s = padatan (s)
- l = cairan (liquid)
- g = gas
- aq = larutan berair (aqueous, zat dalam air)
Beberapa hal yang perlu diperhatikan dalam persamaan reaksi kimia adalah sebagai berikut.
1. Angka koefisien reaksi menyatakan perbandingan jumlah partikel dari zat-zat yang terlibat dalam reaksi.
Secara skematis, reaksi tersebut dapat digambarkan sebagai berikut.
2. Karena koefisien reaksi merupakan angka perbandingan, maka haruslah bilangan bulat yang sederhana.
3. Persamaan reaksi yang sudah diberi koefisien yang sesuai disebut persamaan reaksi yang sudah setara.
Baca : Latihan Soal Persamaan Reaksi Kimia Kelas 10 SMA MA
Penyetaraan Persamaan reaksi
Penyetaraan persamaan reaksi dimaksudkan untuk menyamakan jenis dan jumlah atom yang berada pada ruas kiri dengan ruas kanan.
Cara menyetarakan persamaan reaksi dapat dilakuka langkah sebagai berikut
a. Tetapkan koefisien salah satu zat, biasanya yang memiliki rumus kimia yang paling kompleks, dengan memberi koefisien 1, sedangkan zat yang lain diberi koefisien sementara dengan simbol huruf.
b. Setarakan terlebih dahulu unsur yang bterkait langsung dengan zat yang diberi koefisien 1 tersebut. (jumlah atom kiti=jumlah atom kanan)
c. setarakan unsur lainnya
Contoh setarakan reaksi berikut.
Al(s) + HCl(aq) → AlCl3(g) + H2(g)
Pembahasan :
1. Tetapkan koefisien AlCl3 = 1, sedangkan zat lainnya dengn huruf
aAl(s) + bHCl(aq) → 1AlCl3(g) + cH2(g)
- Penyetaraan atom Al dan Cl
Unsur Ruas kiri = Ruas kanan
Al a = 1
Cl b = 3
Sehingga dapat langsung ditemukan niali a = 1 dan b = 3
- Penyetaraan atom H
Unsur Ruas kiri = Ruas kanan
H b = 2c
3 = 2c
c = 3/2
c = 1.5
aAl(s) + bHCl(aq) → 1AlCl3(g) + cH2(g)
1Al(s) + 3HCl(aq) → 1AlCl3(g) + 1,5H2(g)
Karena koefiien pecahan, maka untk membulatkan koefisien dengan cara dikalikan dua, menjadi.
2Al(s) + 6HCl(aq) → 2AlCl3(g) + 3H2(g)
Contoh penerapan Soal
Setarakan reaksi berikut!
Al(s) + H2SO4(aq) → Al2(SO4)3(aq) + H2(g)
Pembahasan:
1. Koefisien zat paling kompleks = 1, sedangkan zat lainnya dengn huruf.
aAl(s) + bH2SO4(aq) → 1Al2(SO4)3(aq) + cH2(g)
2. Unsur yang berkaitan dengan Al2(SO4)3 adalah Al, S dan O
Menyetarakan atom Al :
Unsur Ruas kiri = ruas kanan
Al a = 2
S b = 3
O 4b = 12
- Penyetaraan unsur H
Unsur Ruas kiri = Ruas kanan
H 2b = 2c
2.3 = 2c
6 = 2c
c = 6/2
c = 3
maka persamaan reaksi setara dari persamaan aAl(s) + bH2SO4(aq) → 1Al2(SO4)3(aq) + cH2(g)
adalah 2Al(s) + 3H2SO4(aq) → 1Al2(SO4)3(aq) + 3H2(g)
Demikian ulasan mengenai pengertian persamaan Reaksi dan cara menyetarakannya. Semoga bermnafaat