Pengertian Sel Volta, Contoh Soal, dan Pembahasannya
Gururbagi.com. Sel volta merupakan sumber arus listrik yang pertama kali ditemukan, dan penemunya adalah Volta dan Galvani.
Reaksi elektrokimia sendiri terjadi di dalam sebuah sel yang dinamakan sel elektrokimia. Sel ini dibagi menjadi dua macam, yaitu sel volta (sel galvani) dan sel elektrolisis. Sel volta adalah kebalikan dari sel elektrolisis yang akan mengubah energi listrik menjadi energi kimia.
Potensi listrik yang dihasilkan sel volta dapat ditentukan dengan alat yang diberi nama voltmeter atau potensiometer.
Adapun prinsip-prinsip yang perlu diperhatikan pada rangkaian sel volta, di antaranya sebagai berikut.
1. Energi kimia diubah menjadi energi listrik.
2. Pada anoda terjadi reaksi oksidasi, sementara pada katoda terjadi reaksi reduksi.
3. Anoda merupakan kutub negatif dan katoda adalah kutub positif.
4. Prinsip kerja sel volta adalah elektron yang mengalir dari anoda menuju katoda.
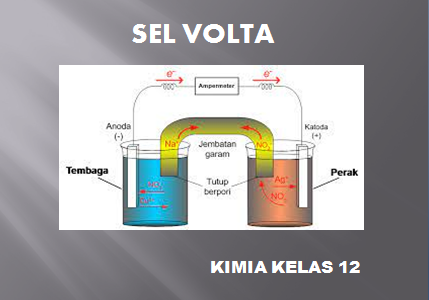
Contoh rangkaian sel volta terdiri dari logam Zn dicelupkan dalam larutan ion Zn2+ dan logam Cu dicelupkan dalam larutan ion Cu2+ .
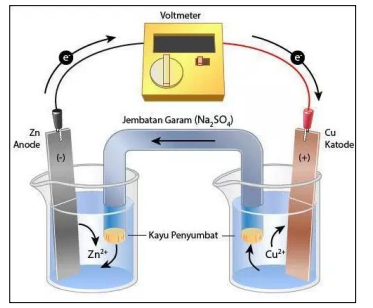
Elektroda dimana reaksi oksidasi disebut anoda, dan elektroda dimanareaksi reduksi terjadi sidebit katoda.
Pada sel volta anoda bermuatan negatif dan katoda bermuatan positif. Elektron mengalir dari anoda menuju aktoda.
Reaksi yang terjadi adalah sebagai berikut.
- Anoda : Zn(s) → Zn2+(aq) + 2e–
- Katoda : Cu2+(aq) → Zn2+(aq) + Cu(s)
- Reaksi sel : Zn(s) + Cu2+→ Zn2+(aq) + Cu(s)
Dengan demikian, pronsip kerjanya adalah pemisahan reaksi redoks menjadi dua bagian, yaitu setengah reaksi oksidasidi anoda dansetengan reaksi reduksi di anoda.
Anoda dan katoda dicelupkan dalam elektrolit dan dihubungkan dengan jembatan garam dan sirkuit luar.
Susunan sel volta pada gambar di atas dapat dinyatakan dengan notasi singkat yang dingan notasi sesebut sel, yaitu.

Potensial sel
Potensila sel elektroda yang dibandingkan dengan elektroda hidrogen yang diukur pada suhu 25oC dan tekanan 1 atm disebut potensial elektroda standar.
Baca : Latihan Soal Hukum Faraday Kimia Kelas 12 SMA MA Kurikulum 2013
Potensial elektroda tersebut mengacu pada reaksi reduksi elektroda, sehingga disebut potensial reduksi standar (Eo reduksi).
Pengertian sel volta dapat ditentukan melalui eksperimen denhgan menggunakan volt meteratau dihitung berdasarkandata potensial elekrtoda standar..
- Unsur yang mempunyai Eo reduksi lebih besar mengalami reaksi reduksi di katoda
- Unsur yang mempunyai Eo reduksi lebih kecil mengalami reaksi oksidasidi anoda.
Menurut Masterton Hurley besarnya Eo sel dirumuskan sebagai berikut.
![]()
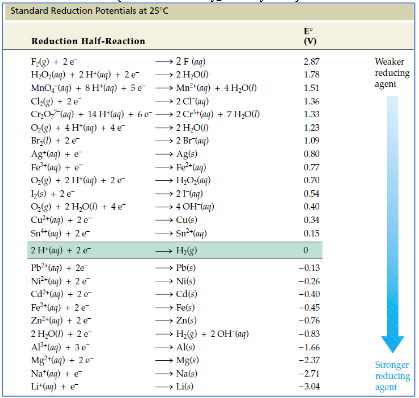
Tabel Potensial Reduski Standar Pada Suhu 25oC
Contoh Soal dan Pembahasan
Soal nomor 1
Diketahui Potensial elektrode perak tembaga sebagai berikut.
Ag+ + e → Ag Eo = + 0,80 V
Cu2+ + 2 e → Cu Eo= + 0,34 V
Tentukan!
a. Diagram sel
b. Harga potensial sel
c. Reaksi selnya
Pembahasan :
a. Karena harga Eo Ag > Eo Cu maka
Katoda : Ag
Anoda : Cu
Sehingga diagram selnya : ![]()
b. Harga potenisl sel Eo sel
Eo sel = Eo reduksi – Eo oksidasi
= 0,80 – 0,34
= 0,46 V
c. Reaksi sel
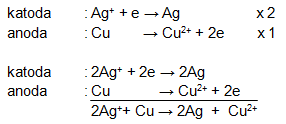
Soal nomor 2
Reaksi redoks berikut berlangsung secara spontan :
2 Al + 6H+ → 2Al3+ + 3H2
Gambarlah rangkaian sel volta berdasarkan reaksi tersebut dan tulis diagram atau notasi sel nya!
Pembahasan :
Gambar rangkaian sel voltanya sebagai berikut.
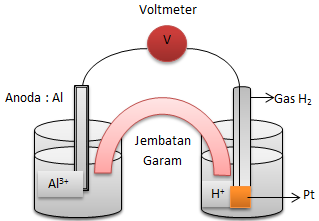
Notasi sel nya sebagai berikut : ![]()
Soal nomor 3
Diketahui data potensial reduksi standar dari logam besi dan timah ialah sebagai berikut.
Fe2+ + 2e → Fe Eo = -0,44 V
Sn2+ + 2e → Sn Eo = -0,14 V
a. Tulislah notasi sel volta dari kedua elektrode tersebut !
b. Berapakah potensial elektrode standar yang dihasilkan dari sel tersebut ?
c. Buatlah reaksi sel dari kedua elektrode tersebut !
Pembahasan :
a. Notasi sel volta
Notasi sel volta, harus mengikuti format berikut.
Anoda |Ion ||Ion | Katoda
Maka notasi sel voltanya ialah :
Fe |Fe2+ ||Sn2+ |Sn
b. Potensial elektrode standar yang dihasilkan dari sel tersebut
Menghitung potensial elektroda dari sel, maka kita gunakan rumus : Esel = Ereduksi –Eoksidasi,
Eosel = EoSn – EoFe
Eosel = -0,14 + 0,44 = 0,30 V
Jadi potensial elektroda yang dihasilkan ialah sebesar 0,3 V
c. Reaksi sel
Untuk menulis reaksi sel, silahkan perhatikan penjelasan dibawah ini :
Anoda = Fe → Fe2+ + 2e
Katoda = Sn2+ + 2e → Sn
Reaksi Sel keseluruhan = Fe + Sn2+ → Fe2+ + Sn Eosel = 0,3 V
Soal nomor 4
Diketahui :
Br2 + 2e → 2Br– Eo = +1,07 V
I2 + 2e → 2I- Eo = +0,54 V
Reaksi Br2 + 2I– → 2Br– + I2
Apakah reaksi diatas dapat berlangsung spontan? Jelaskan!
Pembahasan :
Untuk menentukan suatu reaksi dapat berlangsung spontan atau tidak, kita dapat mencari besar potensial elektrodanya dengan cara menggunakan rumus yang telah kita gunakan sebelumnya.
Apabila nilai potensial elektrodanya bernilai positif maka reaksi tersebut dapat berlangsung dan begitu juga sebaliknya. Sekarang mari kita cari nilai potensial elektroda dari reaksi di atas.
Esel = Ereduksi – Eoksidasi
Esel = 1,07 – 0,54 = +0,53 V
Oleh karena itu, reaksi di atas dapat berlangsung spontan
Demikian ulasan mengenai pengertian sel volta, contoh soal, dan pembahasannya. Semoga bermanfaat.

Terimakasih pak ,saya jadi lebih paham kimia
Sama-sama, terima kasih kunjungannya.