pH Larutan Garam : Pengertian, Rumus, dan Contoh Soalnya
Gurubagi.com. Garam merupakan salah satu kebutuhan pelengkap dari kebutuhan pangan, selain itu juga garam merupakan sumber elektrolit bagi tubuh manusia.
Garam pada umumnya merupakan hasil reaksi antara senyawa asam dan basa. Pada beberapa pecobaan juga ditunjukkan bahwa sifat asam akan hilang dan berubah menjadi netral apabila direaksikan dengan basa dengan jumlah yang tepat habis.
Reaksi antara larutan asam dengan larutan basa untuk membentuk larutan yang bersifat netral disebut dengan netralisasi atau penetralan.
A. Reaksi Netralisai
Reaksi netralisasi adalah reaksi yang terjadi pada asam dan basa yang membentuk garam diikuti dengan pembentukan molekul air.
Persamaan umum reaksi netralisasi adalah : HA + BOH → BA + H2O
Kebalikan dari reaksi netralisasi disebut reaksi hidrolisis garam. Reaksi ini terjadi antara garam yang bereaksi dengan air membentuk asam atau basa.
Persamaan umum reaksi hidrolisis adalah : BA + H2O → HA + BOH
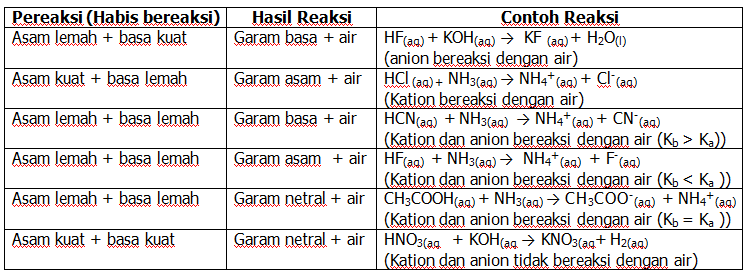
Berikut ini beberapa jenis reaksi netralisasi.
B. pH larutan Garam
Di dalam larutan garam terjadi reaksi hidrolisis. Reaksi hidrolisis adalah suatu penguraian dalam air. Sedangkan hidrolisis garam adalah penguraian garam menjadi ion positif dan ion negatif yang terjadi di dalam air.
Hidrolisis garam pada dasarnya merupakan reaksi asam basa Bronsted-Lowry. Berdasarkan asam basa pembentuknyagaram dibedakan menjadi empat, yaitu.
1. Garam dari asam kuat dan basa kuat
Larutan garam yang berasal dari asam kuat dan basa kuat ini bersifat netral atau tidak terhidrolisis dalam air. Larutannya memiliki pH = 7, seperti NaCl dan K2SO4
2. Garam dari asam lemah dan basa kuat
Larutan garam yang berasal dari asam lemah dan basa kuat ini mengalami hidrolisis sebagian (parsial) dalam air.
Anion pada garam ini mengalami hidrolisis. Larutan garam yang terhidrolisis bersifat basa dengan pH > 7. Contohnya seperti CH3COONa dan Na2CO3.
Baca :
Keberadaan garam tersebut dalam air akan menyebabkan pH naik, karena [H+] dan [OH–] bertambah. Tetapan hidrolisis (Kh) dari reaksi hidrolisis tersebut yaitu:
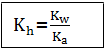
Besarnya pH garam ditentukan dari konsentrasi ion OH– dalam larutan garam tersebut, dengan menggunakan rumus sebagai berikut.
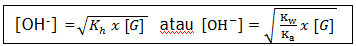
![]()
Keterangan:
Ka = tetapan kesetimbangan asam
Kw = tetapan kesetimbangan = 10-14
Kh = tetapan hidrolisis
[G] = Konsentrasi anion garam terhidrolisis
3. Garam dari asam kuat dan basa lemah
Garam yang berasal dari asam kuat dan basa lemah mengalami hisrolisis sebagian (parsial) dalam air.
Garam mengandung kation asam (Kation yang memberi proton pada air) yang mengalami hidrolisis. Seperti garam NH4Cl, di dalamiar garam tersebut terionisasi dengan persamaan sebagai berikut : NH4Cl (aq) → NH4+ (aq) + Cl– (aq)
Ion NH4+ dari garam NH4 Cl berasal dari basa lemah NH4OH akan bereaksi dengan ion OH– dari air membentuk reaksi berikut in: NH4+(aq) + H2O(l) ↔ NH3(aq) + H3O+(aq)
Sementara ion Cl dari garam NH4Cl yang berasal dari asam kuat HCl tidak bereaksi dengan ion H+ dari air, sehingga garam ini terhidrolisis sebagian atau terhidrolisis parsial.
Adanya garam ini dalam air dapat menyebabkan penurunan pH (pH <7). Besarnya pH dari garam tersebut dapat ditentukan dengan rumus tetapan hidrolisis sebagai berikut.

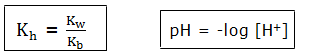
Keterangan:
Kb = tetapan kesetimbangan basa
Kw = tetapan kesetimbangan = 10-14
[G] = konsentrasi kation garam terhidrolisis
Contoh Penerapan
Tentukan pH larutan (NH4) 2SO4 0,01 M yang terhidrolisis sebagian dalam air! (Kb = 1,8.10-5).
Pembahasan:
Diketahui
Konsentrasi (NH4) 2SO4 = 0,01M
n (valensi asam) = 2
Karena(NH4) 2SO4 merupakan garam yang berasal dari asam kuat dan basa lemah, maka rumus yang digunakan adalah :
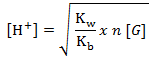
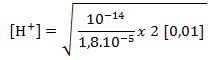
[H+]=3.10 -6 M
pH = -log [H+]
[H+] = – log (3.10 -6)
[H+]= 6 -l og 3
4. Garam dari asam lemah dan basa lemah
Garam yang berasal dari asam lemah dan basa lemah dapat terhidrolisis sempurna karena ion-ion dari garam dapat bereaksi dengan ion-ion dari air.
Salah satu contohnya adalah CH3COONH4 (ammonium asetat), yang terionisasi menurut reaksi : CH3COONH4(aq) → CH3COO–(aq) + NH4+(aq)
Karena H2O terionisasi menjadi H+ dan OH–, maka ion CH3COO– dari garam CH3COONH4 yang berasal dari asam lemah CH3COOH dan bereaksi dengan ion H+ dari air.
Sesuai persamaan reaksi berikut : CH3COO–(aq) + H2O(l) → CH3COOH(aq) + OH–(aq)
Adapun ion NH4+ dari garam CH3COONH4 dari basa lemah NH4OH, bereaksi dengan ion OH– dari air menurut reaksi : NH4+(aq) + H2O(l) → NH3(aq) + H3O+(aq)
Larutan garam yang terbentuk dari asam lemah dan basa lemah dapat bersifat asam, basa, netral .Karena garam ini terhidrolisis sempurna, maka harga pH bukan tergantung pada konsentrasi garamnya, tetapi bergantung pada harga Ka dan Kb-nya.
- Jika Ka = Kb ,larutan garam bersifat netral (pH=7)
- Jika Ka > Kb , larutan garam bersifat asam (pH<7)
- Jika Ka < Kb , larutan garam bersifat basa (pH>7)
Harga pH untuk larutan dapat ditentukan dengan rumus sebagai berikut.

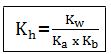
Contoh Penerapan.
Tentukan banyaknya garam CH3COONa dalam laritam 100 ml CH3COONa, dengn pH = 9!
( Mr CH3COONa = 42, Ka = 1,8.10 -5)
Pembahasan:
Diketahui
CH3COONa = 100 ml = 0,1 L
pH = 9
Mr CH3COONa = 42
Ka = 1,8.10 -5
Ditanyakan banyaknya garam yang dalam larutan (massa garam) ?
CH3COONa merupakan garam yang berasal dari asam lemah dan basa kuat maka rumus mencari konsentrasi massa garam melalui rumus:
Massa = mol x Mr
sedangkan Mol = volume x M
Mula-mula kita mencari molaritas garam [G] terlebih dahulu, dengan rumus sebagai berikut.
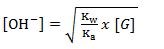
pH = 9
pOH = 14 -pH
pOH 14-9
pH = 5, sehingga didapatkan [OH–] =10-5
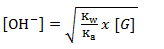
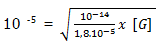
[G] = 0,18 M
mol CH3COONa = volume x M
mol CH3COONa = 0,1 L x 0,18 M
CH3COONa = 0,018 mol
Mencari massa CH3COONa = mol x Mr
Massa CH3COONa = 0,018 x 42
Massa CH3COONa = 0,756 gram
Demikian ulasan materi pengertian pH larutan garam, rumus, dan contoh soalnya. Semoga bermanfaat


