pH Larutan Penyangga : Pengertian, Jenis, Rumus, dan Contoh Soalnya
Gurubagi.com. Larutan penyangga pada umumnya dibuat untuk menstabilkan kadar pH, baik pH dalam tubuh maupun reaksi-reaksi kimia di laboratorium. Pengertian larutan penyangga adalah larutan yang dapat mempertahankan pH. Larutan penyangga disebut juga larutan Buffer atau dapar.
Jika ke dalam air murni (pH = 7) ditambahkan 0,01 M NaOH ke dalam air, pH akan naik menjadi 12,. Sedangkan jika kita tambahkan sedikit larutan asam ke dalam air pH akan turun. Oleh karena itu, air murni tidak memiliki kemampuan untuk mempertahankan pH.
Larutan penyangga relatif tidak berubah dengan penambahan sedikit asam atau basa, meskipun kedalam larutan tersebut ditambahkan sedikit asam atau basa atau dilakukan proses pengenceran.
Akan tetapi penambahan larutan asam atau basa ke dalam alrutan bukan penyangga, akan menyebabkan perubahan pH yang sangan sangat drastis
Jenis-jenis Larutan Penyangga
Secara umum, larutan Penyangga terbagi atas larutan penyangga sam dan larutan penyangga basa. Berikut penjelasan mengenai larutan penyangga asam dan basa.
1. Larutan Penyangga Asam
Larutan penyangga asam adalah larutan yang mengandung asam lemah dan basa konjugasinya. Larutan ini dapat mempertahankan pH pada kondisi asam atau pH kurang dari 7 (pH < 7). Larutan ini bisa didapat dengan mencampurkan asam lemah dan garamnya atau asam lemah berlebih dengan basa kuat.
Baca :
- pH Larutan Garam : Pengertian, Rumus, dan Contoh Soalnya
- pH Larutan Asam Basa, Pengertian, Rumus, Soal dan Pembahasannya
Rumus larutan penyangga asam :
Larutan penyangga asam berasal dari asam lemah dan basa konjugasinya.
CH3COOH ↔ H+ + CH3COO–

Keterangan :
a = jumlah mol asam lemah
g = jumlah mol asam konjugasi atau basa konjugasi
Contoh Soal
Soal nomor 1
Hitunglah pH campuran dari 50 ml larutan CH3COOH 0,1 M larutan CH3COONa 0,1 M.
(Ka = 1,8.10-5, log 9 = 0,95).
Pembahasan :
Diketahui:
Volume CH3COOH = 50 ml
[CH3COOH]= 0,1 M
Volime CH3COONa = 100 ml
[CH3COONa] = 0,1 M
Ka = 1,8.10-5
Ditanyakan pH campuran larutan tersebut,?
Campuran CH3COOH dengan larutan CH3COONa bersifat penyangga asam karena mengandung asam lemah dan basa konjugasinya. Untuk mencari pH campuran maka menggunakan rumus berikut ini.
pH = – log [H+]
![]()
Sebelum mencari pH larutan penyangga maka mencari [H+] sebagai berikut.
Jumlah mol CH3COOH = volume x M = 50 x 0,1 = 5 mmol
Jumlah mol CH3COONa = Volume x M = 100 x 0,1 = 10 mmol
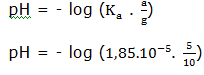
= – log (1,8.10-5 . 0,5)
= – log (9.10-6)
= 6 – log 9
= 6 – 0,95
= 5,05
Soal nomor 2
Sebanyak 100 ml larutan CH3COOH 1M dicampur dengan 100 ml larutan CH3COONa 1 M. Tentukan pH larutan setelah penambahan 10 ml HCl (Ka = 1,8.10-5, log 2,2 = 0,34)!
Pembahasan :
Diketahui
Volume CH3COOH = 50 ml
[CH3COOH]= 0,1 M
Volume CH3COONa = 100 ml
[ CH3COONa] = 0,1 M
Volume HCl = 10 ml
[HCl] = 1 M
Ka = 1,8.10-5
Ditanyakan pH larutan setelah penambahan HCl?
Untuk mencari pH campuran maka menggunakan rumus :
pH = – log [H+]
![]()
Jumlah mol CH3COOH = volume x M = 100 x 1 = 100 mmol
Jumlah mol CH3COONa = Volume x M = 100 x 1 = 100 mmol
Jumlah mol HCl = Volume x M = 10 x 1 = 10 mmol
Susunan larutan setelah penambahan HCl adalah sebagai berikut.
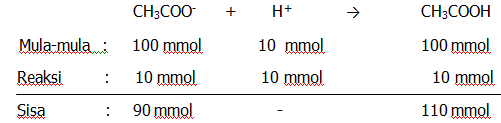
pH = – log [H+]
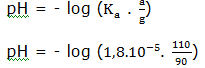
pH = 2,2.10-5
pH =- log 2,2.10-5
pH = 5 – log 2,2
pH = 5 – 0,34
ph = 4,66
2. Larutan Penyangga Basa
Larutan penyangga basa merupakan larutan yang berasal dari basa lemah dan asam konjugasinya.
Larutan ini berfungsi untuk mempertahankan pH pada kondisi basa yang mempunyai pH lebih besar dari 7 (pH > 7).
Larutan penyangga basa dapat diperoleh dengan mencampur basa lemah dengan garamnya atau basa lemah berlebih dengan asam kuat.
Rumus larutan penyangga basa :
Larutan penyangga basa berasal dari basa lemah dan asam konjugasinya.
NH3 + H2O ↔ NH4+ + OH–

pOH = – log [OH–]
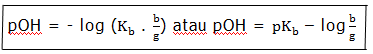
pH = 14 – pOH
Keterangan :
b = jumlah basa lemah
g = jumlah mol basa konjugasi
Contoh Soal pH Larutan Penyangga
Tentukan pH larutan dari campuran 50 ml larutan NH3 0,2 M + 100 ml larutan NH4Cl 0,1 M
(Kb = 1.10-5)
Pembahasan :
Diketahui
Volume NH3 =50 ml
[NH3] = 0,2 M
Volime NH4Cl = 100 ml
[NH4Cl] = 0,1 M
Ditanyakan pH larutan?
Campuran tersebut merupakan penyangga basa, sehingga pH campuran menggunakan rumus :
pH = 14 – pOH
pOH = – log [OH–]
Jumlah mol NH3 = volume x M = 50 x 0,2 = 10 mmol
Jumlah mol NH4Cl = Volume x M = 100 x 0,1 = 10 mmol
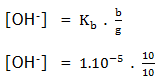
[OH–] = 1.10-5
pOH = 5 –log1
pOH = 5
Sehingga pH = 14 – 5 = 9
Daerah Penyangga pada Kurva Titrasi
Berikut ini daeraah penyangga (buffer) pada kurva titrasi asam basa
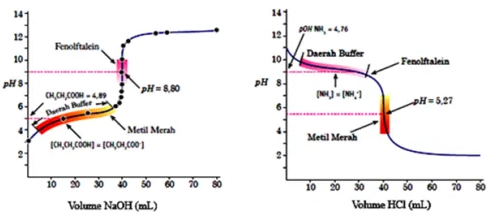
Dari kurva tersebut di atas, terlihat bahwa pada awal titrasi dengan penambahan NaOH dan HCl masing-masing sebanyak 30 ml, terlihat bahwa pH larutan tidak berubah.
Hal ini dikarenakan pada awal titrasi baik asam lemah (CH3COOH) atau basa lemah (NH3) masih bersisa. Sehingga di dalam labu titrasi tersebut terdapat campuran asam lemah atau basa lemah dan garamnya yang terbentuk menyebabkan pH tidak berubah.
Demikian ulasan mengenai pengertian pH larutan penyangga, jenis, rumus, dan contoh soalnya. Semoga bermanfaat.


