Sifat Koligatif Larutan Elektrolit, Soal, dan Pembahasannya
Gurubagi.com. Sifat koligatif larutan merupakan sifat zat yang hanya ditentukan oleh banyaknya partikel zat terlarut.
Sifat koligatif larutan adalah suatu sifat larutan yang hanya dipengaruhi oleh jumlah partikel zat terlarut yang terdapat dalam larutan, akan tetapi tidak tergantung pada jenis zat yang dilarutkan.
Semakin banyak zat terlarut, maka sifat koligatif akan semakin besar. Misalnya, melarutkan melarutkan gula dengan air panas dalam jumlah yang berbeda.
Jika gelas yang pertama, Anda melarutkan 3 sendok teh gula dengan 500 ml air. Sementara itu, untuk gelas kedua, kamu melarutkan 5 sendok teh gula dengan jumlah air yang sama, yaitu 500 ml juga.
Karena gula merupakan zat terlarut, dan jumlahnya lebih banyak di gelas kedua, maka sifat koligatif larutan gelas kedua akan lebih besar dibandingkan sifat koligatif larutan di gelas pertama.
Sifat koligatif larutan terdiri atas empat macam, yaitu penurunan tekanan uap (ΔP), penurunan titik beku (ΔTf), kenaikan titik didih (ΔTb), dan tekanan osmotik (π).
Sifat koligatif larutan bergantung pada jumlah zat terlarut dalam larutan yang dinyatakan sebagai konsentrasi.
Baca : Latihan Soal Materi Sistem Periodik Unsur SPU Kelas 10 SMA MA
Konsentrasi yang digunakan pada sifat koligatif larutan yaitu molalitas (m), molaritas (M) dan fraksi mol (X) yang dirumuskan sebagai berikut.
1. Molaritas M
Molaritas merupakan banyaknya mol zat terlarut dalam tiap liter larutan (mol L-1) disebut molaritas
![]()
g = massa zat terlarut (gram)
Mr = massa molekul relatif zat terlarut
2. Molalitas
![]()
Banyaknya mol zat telarut dalam tiap kg pelarut (mol kg-1)
Keteranga :
g = massa zat gerlarut (gram)
P = massa pelarut (gram)
Mr = massa molekul relative zat terlarut
3. Fraksi mol
Banyaknya mol suatu komponen dalam larutan dibagi banyaknya mol seluruhnya
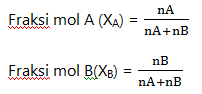
Keterangan:
XA = fraksi mol zat terlarut A
XB = fraksi mol zat terlarut B
nA = mol zat terlarut A
nB = mol zat terlarut B
Berdasarkan daya hantar listriknya, sifat koligatif larutan terbagi menjadi dua jenis, yaitu larutan elektrolit dan nonelektrolit.
Kedua sifat koligatif larutan ini tentunya punya ciri dan perbedaannya masing-masing. Selain itu, rumus sifat koligatif larutan elektrolit dan nonelektrolit keduanya juga berbeda.
Berikut ini ulasan mengenai sifat koligatif larutan elektrolit, soal, dan pembahasannya
Sifat Koligatif Larutan Elektrolit
Sifat koligatif larutan elektrolit merupakan sifat koligatif yang dimiliki oleh larutan yang zat terlarutnya dapat terionisai atau terurai menjadi ion-ionnya.
Contoh yang termasuk larutan elektrolit, yaitu larutan asam, basa dan garam. Akibat ionisasi tersebut, jumlah partikel bertambah sehingga sifat koligatif larutan elektrolit lebih besar dari pada sifat koligatif larutan nonelektrolit dengan konsentrasi yang sama.
Dengan demikian Jacobus Henricus Van’t Hoff mengoreksi hukum Raoult agar sesuai untuk alrutan elektrolit. Hukum Raoult kemudian dikalikan dengan suatu faktor yang diberi lambang i dan disebut faktor Van’t Hoff.
i = (1 + (n + α (n-1))
α = 
Pada dasarnya, larutan elektrolit ini dibagi menjadi 2 jenis, yaitu larutan elektrolit kuat dan lemah.
Pada elektrolit kuat, senyawa terionisasi sempurna sedangkan pada elektrolit lemah senyawa hanya terionisasi sebagian. Hal ini membuat perhitungan pada kedua jenis larutan tersebut berbeda.
Elektrolit kuat
Pada larutan elektrolit kuat derajat ionisasinya sama dengan 1 karena terionisasi sempurna, sehingga berlaku persamaan :
1. Penurunan Tekanan Uap (ΔP)
ΔP = XA . Po . i
ΔP = XA . Po .( 1+α (n-1) )
2. Penurunan titik didih (ΔTb)
ΔTb = Kb . mt . i
3. Penurunan Titik Beku ( ΔTf )
ΔTf = Kf . mt . i
4. Tekanan Osmotik
π = M.R.T.i
Elektrolit lemah
Sedangkan pada larutan elektrolit lemah, senyawa tidak terionisasi sempurna sehingga faktor van’t Hoff (i) = (1 + α (n – 1)). Sehingga berlaku persamaan :
1. Penurunan Tekanan Uap (ΔP)
ΔP = Xt . Po . (1 + (n – 1))
2. Kenaikan Titik Didih (ΔTb)
ΔTb = Kb . mt . (1 + α (n – 1))
3. Penurunan Titik Beku ( ΔTf )
ΔTf = Kf . mt . (1 + α (n – 1))
4. Tekanan Osmotik ( π )
π = M.R.T. (1 + α (n – 1))
Soal dan Pembahasan
Soal nomor 1
Larutan garam yang terbuat dari x gram NaCl (Mr = 59 g/mol) dalam 200 gram air mempunyai tekanan uap 1 atmn pada suhu 100,40C. Jika Kb air = 0,50 C/molal, maka nilai x adalah…..
Penyelesaian :
NaCl merupakan elektrolit kuat (α = 1) dengan jumlah ion n = 2, jadi i = n
ΔTb = Kb . x . i
100,4 – 100 = 0,5 . x . 2
0,4 = 0,5 . x 5 . 2
X = = 4,72 gram
Soal nomor 2
Tentukan kemolalan larutan yang mengandung 10 gram NaCl dalam 200 ml air (massa jenis air = 1 g/ml)
Pembahasan :
![]()
![]()
m = o,85
Soal nomor 3
Jika 11,7 gram NaCl mengion sempurna (nilai i = nilai teoritis) dalam 1 Liter, Kb air = 0,52 oC/m, kf air = 1,86 oC/m. Tentukan
a. titik didih
b. titik beku larutan
Pembahasan :
massa NaCl = 11,7 gram
Kb air = 0,52 oC/m
kf air = 1,86 oC/m
NaCl merupakan elektrolit kuat, sehingga i = n = 2
Mencari molalitas (m) terlebih dahulu
![]()
![]()
m = 0,2
a. Titik didih
ΔTb = Kb . m . i
ΔTb = 0,52 . 0,2 . 2
ΔTb = 0,208
maka Tbi = 100 + 0,208 = 100,208oC
b. Titik beku
ΔTf = Kf . mt . i
ΔTf = 1,86 . 0,2 . 2
ΔTf = 0,744
Tfo – Tf1 = 0,744
Tf1= 0 – 0,744
Tf1 = -0,744oC
Soal nomor 4
Berapakah derajat ionisasi larutan elektrolit lemah biner dengan konsentrasi 0,1 M pada suhu 27oC dan tekanan osmotik 4,305
Pembahasan :
konsentrasi larutan = 0,1 M
π = 4,305
T = 27 + 273 = 300oC
π = M . R . T { 1 + (n-1) α}
4,305 = 0,1 . 0,082 . { 1 + (2-1) α }
{1 + α} = 4,305 : 0,1 .0,082 . 300
1 + α = 1,75
α = 1,75 – 1
α = 0,75
Jadi larutan biner tersebut mempunyai derajat ionisasi sebesar 0,75.
Demikian ulasan mengenai sifat koligatif larutan slektrolit, soal, dan pembahasannya. Semoga manfaat.