Sifat Unsur Logam Alkali Tanah, Kegunaan, dan Kelimpahannya di Alam
Gurubagi.com. Kimia unsur merupakan bidang ilmu kimia yang khusus mempelajari unsur-unsur yang telah ditemukan termasuk unsur logam alkali tanah.
Pada tabel periodik unsur, dikelompokkan menjadi beberapa golongan, di antaranya golongan logam alkali, logam alkali tanah, halogen, gas mulia, dan unsur transisi.
Unsur-unsur tersebut di alam ini ada yang terdapat di dalam kulit bumi, udara ataupun laut. Berikut ini akan kita bahas salah satu golongan unsur, yaitu unsur logam alkali tanah.
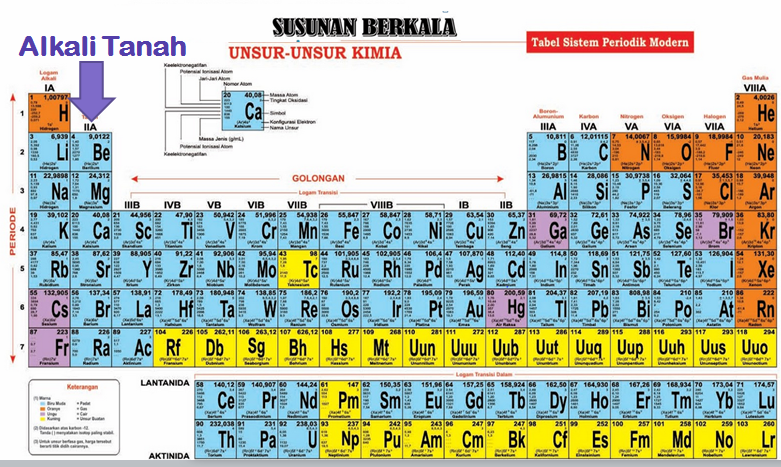
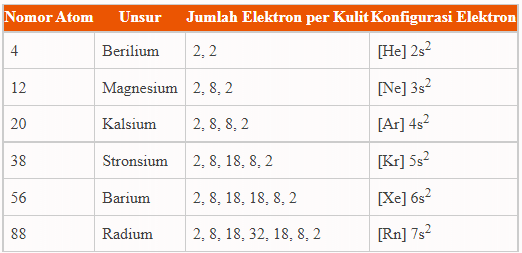
Unsur-unsur golongan IIA disebut juga unsur logam alkali tanah, unsur tersebut diantaranya adalah berilium (Be), magnesium (Mg), kalsium (Ca), stronsium (Sr), dan barium (Ba).
Unsur-unsur trsebut disebt golongan alkali tanah karena unsur-unsur tersebut bersifat basa dan banyak ditemukan dalam mineral tanah.
Logam alkali tanah umumnya reaktif, akan tetapi kurang rektif jika dibandingkan dengan logam alkali. Berikut ini akan kita bahas mengenai sifat logam alkali tanah, kegunaan dan kelimpahannya di alam.
Sifat Unsur Logam Alkali Tanah
Alkali tanah terletak pada golongan IIA dengan elektron valensi 2, yaitu 2n2. Dengan jumlah elektron valensi yang sangat kecil, maka golongan alkali tanah termasuk golongan yang mudah bereaksi dengan unsur lain.
Berikut ini sifat unsur alkali tanah.
- Sifat fisika unsur alkali tanah
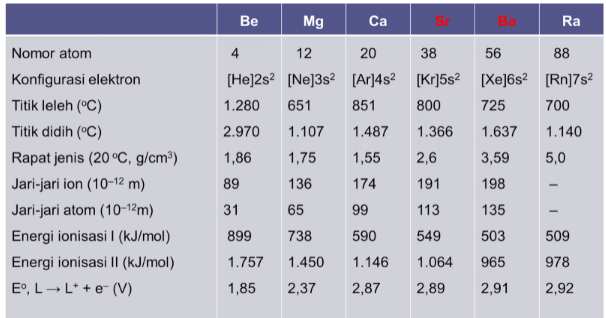
a. Kekerasan logam alkali tanah berkurang dari atas ke bawah akibat kekuatan ikatan antar atom menurun, karena jarak antar atom menjadi semakin panjang.
b. Titik leleh dan titik didih logam alkali menurun dari atas ke bawah dalam sistem periodik unsur, hal ini disebabakn oleh jari-jari atom yng bertambah panjang.
c. Energi ionisasi kedua dar relatif rendah, sehingga mudah membentuk kation +2.
d. Kelektronegatifan rata-rata golongan ini juga rendah karena ukuran atom dan jarak yang reltif besar antara elektron terluar dengan inti.
Untuk lebih jelas, perhatikan berikut ini sifat fisik logam alkali tanah.
Sifat kimia unsul logam alkali tanah
Logam alkali tanah cenderung kurang reaktif dibandingkan denan logam alkali karena energi ionisasinya lebih besar dari pada logam alkali tanah. Keraktifan logam alkali tanah dalam satu golongan semakin ke bawah semakin besar.
Berikut ini sifat kimia dari unsur logam alkali tanah
a. Alkali tanah merupakan reduktor yang kuat
Sifat reduksi unsur ini semakin ke kiri dalam satu periode semakin kuat dan semakin kebawah dalam satu golongan semaki kuat.
b. Dapat bereaksi dengan hidrogen
Semua logam alkali tanah bereaksi dengan hidrogen membentuk hidrida logam. Berikut adalah contoh dari reaksi:
Ca(s) + H2 (g) → CaH2 (s)
c. Dapat bereaksi dengan oksigen
Logam alkali tanah bereaksi dengan oksigen untuk menghasilkan oksida logam.
2X + O2 → 2XO
Keterangan X : Be, Mg, Ca, Sr, Ba
Contoh reaksi lain dari logam alkali tanah dengan oksigen.
Sr (s) + O2 (g) → SrO2 (s)
d. Logam alkali tanah dapat bereaksi dengan nitrogen
Reaksi ini tidak dapat terjadi jika tidak dalam kondisi ekstrim. Sebagai contoh, suatu senyawa dapat dibuat melalui suhu sangat tinggi. Persamaan reaksinya adalah:
3Mg (s) + N2 (g) → Mg3N2 (s)
e. Reaksi dengan halogen
Ketika bereaksi dengan halogen, logam alkali tanah akan membentuk halida logam. Persamaan reaksi kimianya adalah :
Mg (s) + Cl2 (g) → MgCl2 (s)
e. Reaksi dengan air
Be tidak bereaksi dengan air. Hanya Mg, Ca, Sr, dan Ba yang dapat bereaksi dengan air membentuk ion hidroksida atau basa. Contoh reaksinya adalah:
Ba (s) + 2H2O (l) → Ba(OH)2 (aq) + H2 (g)
f. Jika logam alkali tanah juga memiliki nyala warna khas seperti logam alkali. warna nyala logam alkali ini dapat digunakan untuk identifikasi awal adanya logam alkali tanah dalam suau bahan. Warna-warna yang dhfasilkan oleh unsur-unsur golongan IIA ini antara lain.
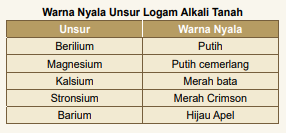
Warna nyala logam alkali tanah

Kegunaan unsur logam alkali tanah
1. Berilium (Be)
a. Berilium digunakan untuk memadukan logam agar lebih kuat, akan tetapi bermasa lebih ringan. Biasanya paduan ini digunakan pada kemudi pesawat Zet.
b. Berilium digunakan pada kaca dari sinar X.
c. Berilium digunakan untuk mengontrol reaksi fisi pada reaktor nuklir
c. Campuran berilium dan tembaga banyak dipakai pada alat listrik, maka Berilium sangat penting sebagai komponen televisi.
2. Magnesium (Mg)
a. Magnesium digunakan untuk memberi warna putih terang pada kembang api dan pada lampu Blitz. Senyawa MgO dapat digunakan untuk melapisi tungku, karena senyawa MgO memiliki titik leleh yang tinggi.
b. Senyawa Mg(OH)2 digunakan dalam pasta gigi untuk mengurangi asam yang terdapat di mulut dan mencagah terjadinnya kerusakan gigi, sekaligus sebagai pencegah maag
c. Mirip dengan Berilium yang membuat campuran logam semakin kuat dan ringan sehingga biasa digunakan pada alat alat rumah tangga.
3. Kalsium (Ca)
a. Kalsium digunakan pada obat obatan, bubuk pengembang kue dan plastik.
b. Senyawa CaSO4 digunakan untuk membuat Gips yang berfungsi untuk membalut tulang yang patah.
c. Senyawa CaCO3 biasa digunakan untuk bahan bangunan seperti komponen semen dan cat tembok.Selain itu digunakan untuk membuat kapur tulis dan gelas.
d. Kalsium Oksida (CaO) dapat mengikat air pada Etanol karena bersifat dehidrator,dapat juga mengeringkan gas dan mengikat Karbondioksida pada cerobong asap.
e. Ca(OH)2 digunakan sebagai pengatur pH air limbah dan juga sebagai sumber basa yang harganya relatif murah
Baca : Sifat Unsur Logam Alkali, Kegunaan, dan Kelimpahannya di Alam
f. Kalsium Karbida (CaC2) disaebut juga batu karbit merupakan bahan untuk pembuatan gas asetilena (C2H2) yang digunakan untuk pengelasan.
g. Kalsium banyak terdapat pada susu dan ikan teri yang berfungsi sebagai pembentuk tulang dan gigi.
4. Stronsium (Sr)
a. Stronsium dalam senyawa Sr(NO3)2 memberikan warna merah apabila digunakan untuk bahan kembang api.
b. Stronsium sebagai senyawa karbonat biasa digunakan dalam pembuatan kaca televisi berwarna dan komputer.
5. Barium (Ba)
a. BaSO4 digunakan untuk memeriksa saluran pencernaan karena mampu menyerap sinar X
b. BaSO4 digunakan sebagai pewarna pada plastic karena memiliki kerapatan yang tinggi dan warna terang.
c. Ba(NO3)2 digunakan untuk memberikan warna hijau pada kembang api.
Kelimpahan logam alkali tanah di alam
Unsur-unsur golongan alkali tanah di alam dapat ditemukan dalam bentuk senyawa atau lebih spesifiknya dalam bentuk mineral tanah.
a. Berilium (Be)

Berilim tidak terlalu familiar, sebagian karena kelimpahannya yang sedikit dan sebagiannya karena kesulitan untuk mengesktraksinya.
Berilium ditemukan dalam jumlah yang kecil sebagai mineral silikat beryl Be3Al2Si6O18, dan phenacite Be2SiO4.
b. Magnesium (Mg)

Magnesium merupakan unsur keenam paling limpah di muka bumi (2,76%). Garam magnesium terdapat sekitar 0,13% dalam air laut. Unsur ini dapat ditemukan dalam mineral dolomite [MgCO3.CaCO3], magnesite MgCO3, epsomite MgSO4.7H2O dan kieserite MgSO4.H2O.
c. Kalsium (Ca)

Kalsium merupakan unsur keenam paling limpah di muka bumi (4,66%) dan terdapat di seluruh bumi dalam mineral-mineral yang umum.
Terdapat tumpukan sedimen CaCO3 yang begitu besar pada pegunungan sebagai batu kapur serta juga pada batu karang di laut.
Meskipun batu kapur warna tipikal putih, namun di banyak tempat warnanya kuning, oranye atau coklat karena mengandung sejumlah kecil besi. Ada dua bentuk kristal CaCO3 yaitu calcite dan aragonite.
Calcite adalah mineral yang lebih umum, membentuk kristal rombohedral yang tak-berwarna. Aragonite adalah ortorombik dan umumnya berwarna merah-kecoklatan atau kuning.
d. Stronsium (Sr)

Stronsium di alam terdapat dalam bentuk mineral celestit dengan rumus kimia SrSO4 dan mineral stronsianat dengan rumus kimia SrCO3.
Kelimpahan unsur lain golongan alkali tanah, Barium ditemukan di alam dalam bentuk mineral barit dengan rumus kimia BaSO4 dan mineral iterit dengan rumus kimia BaCO3.
Unsur terakhir pada golongan alkali tanah, yaitu Radium. Unsur ini memiliki sifat radioaktif sehingga terdapat di alam dalam jumlah kecil pada bijih uranium.
e. Barium (B)

Kelimpahan barium adalah 0,0425% dalam kerak bumi dan 13 µg/L dalam air laut. Sumber komersial utama barium adalah barit, mineral barium sulfat dengan deposit di banyak belahan dunia.
Sumber komersial lain, yang jauh kurang penting daripada barit, adalah witerit, mineral barium karbonat.
Demikian ulasan mengenai sifat unsur logam alkali tanah, kegunaan, dan kelimpahannya di alam. Semoga bermanfaat.