Stoikiometri : Pengertian Berikut Penjelasannya
Gurubagi.com. Dalam ilmu kimia, stoikiometri adalah ilmu yang mempelajari kuantitas suatu zat dalam reaksi kimia. Zat-zat tersebut meliputi massa, jumlah mol, volume, dan jumlah partikel.
Kata Stoikiometri berasal dari kata yang “stoicheion” yang dalam bahasa Yunani berarti mengukur
Stoikiometri juga diartikan sebagai perhitungan kimia yang menyangkut hubungan kuantitatif zat yang terlibat dalam reaksi.
Hukum Dasar Kimia untuk Stoikiometri

Di dalam perhitungan kimia secara stoikiometri memerlukan hukum-hukum dasar yang relevan. Berikut ini beberapa hukum dasar yang penting diantaranya adalah :
1. Hukum Kekekalan Massa (Lavoisier)
Pada Hukum kekalam massa menyatakan bahwa massa total suatu bahan sesudah reaksi kimia sama dengan massa total bahan sebelum reaksi.
Contohnya, massa kertas sebelum dibakar memiliki massa yang sama dengan massa kertas sesudah pembakarannya.
2. Hukum Perbandingan Tetap (Joseph Proust 1799)
Joseph Proust menyatakan perbandingan massa unsur-unsur penyusun suatu senyawa selalu tetap.
Seperti, perbandingan massa Hidrogen dan Oksigen dalam air adalah 1:8, tidak bergantung pada jumlah air yang dianalisis.
3. Hukum Perbandingan Berganda (John Dalton 1803)
Hukum perbandingan berganda berbunyi “jika ada dua unsur yang dapat membentuk lebih dari satu senyawa, perbandingan massa unsur yang satu, yang bersenyawa dengan unsur lain yang tertentu massanya adalah bilangan bulat dan sederhana”.
Contoh Soal
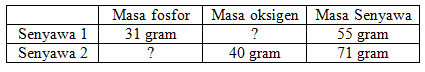
Unsur fosfor dan oksigen yang direaksikan membentuk dua jenis senyawa. Dalam 55 gram senyawa I terdapat 31 gram fosfor dan 71 gram senyawa II mengandung 40 gram oksigen. Apakah senyawa tersebut termasuk ke dalam hukum Dalton?
Pembahasan:
Penjelasan :
Massa oksigen pada senyawa 1 = 55 – 31 = 24
Massa fosfor pada senyawa 2 = 71 – 40 = 31
Perbandingan massa fosfor pada senyawa 1 dan 2 adalah
= 31 : 31 → dibagi dengan 31 = 1 : 1
Perbandingan oksigen pada senyawa 1 dan 2 adalah
= 24 : 40 → dibagi dengan 8 = 3 : 5
Dari hasil tersebut perbandingan oksigen dan fosfor pada senyawa 1 dan 2 yaitu 1:1 dan 3:5 merupakan bilangan bulat dan sederhana.
4. Hukum Perbandingan volume (Joseph Gay Lussac)
Ilmuwan asal Prancis, ini melalukan penelitiannya, dan mengambil kesimpulan bahwa perubahan volume gas dipengaruhi oleh suhu dan tekanan.
Bunyi dari hukum perbandinganm, sebagai berikut: “Jika diukur pada Suhu dan Tekanan yang sama, maka Volume gas yang bereaksi dan gas hasil reaksi berbanding sebagai bilangan bulat dan sederhana.”
Contoh soal :
Pada suhu dan tekanan tertentu, 1 liter gas Nitrogen bisa bereaksi dengan 3 liter gas Hidrogen, hingga menghasilkan 2 liter gas amonia (2NH3)m da[at dilihat pada persamaan reksi di bawah ini.
1N2 + 3H2 → 2NH3
5. Hipotesis Avogadro (Amadeo Avogadro)
Seorang ilmuwan asal Italia ini melengkapi hukum dasar kimia yang digunakan untuk stoikiometri.. yang menyatakan bahwa partikel unsur tidak selalu berupa atom yang berdiri sendiri, melainkan bisa berbentuk molekul unsur.
Hipotesis dari Avogadro itu lantas mengatakan: “Pada suhu dan tekanan yang sama, perbandingan gas yang bervolume sama memiliki jumlah molekul yang sama juga”.
Contohnya, H2, O2, N2, dan P4.
Konsep Kimia yang Harus Dipahami dalam Stoikiometri
Stoikiometri larutan adalah perhitungan kimia yang mengaitkan rumus kimia dan reaksi yang berlangsung dalam larutan.
Untuk mempelajari materi Kimia Stoikiometri, terdapay beberapa konsep yang harus difahami terlebih dahulum yaitu:
a. Massa Atom Relatif (Ar)
Massa atom relatif merupakan perbandingan massa suatu atom dengan 1/12 kali massa suatu atom isotop karbon-12 atau C-12. Isotop C-12, digunakan sebagai standar karena mempunyai kestabilan inti yang inert dibandingkan dengan atom lainnya.
b. Massa Molekul Relatif (Mr)
Massa molekul relatif digunakan mencari perbandingan massa satu molekul senyawa dengan 1/12 kali massa satu atom isotop karbon-12 atau C-12. Dalam hal ini, molekul merupakan gabungan dari atom-atom suatu unsur. Jadi, Mr merupakan jumlah Ar atom-atom penyusunnya, atau dapat dirumuskan dengan Mr = ΣAr.
Contoh Soal
Soal nomor 1
Jika diketahui, massa atom relatif C=12, H=1, O=16. Maka, hitunglah massa molekul relatif senyawa CH3COOH.
Rumus Mr = ∑ Ar
Mr CH3COOH = 2 x Ar C + 4 x Ar H + 2 x Ar O.
Mr CH3COOH = 2 x 12 + 4 x 1 + 2 x 16 = 60.
Maka, Mr dari senyawa tersebut adalah 60.
Soal nomor2
Diketahui, massa atom relatif (Ar) O=16, Al =27 dan S=32. Maka, hitunglah massa molekul relatif Al2(SO4)3!
Mr = ∑ Ar
Mr Al2(SO4)3 = (2 x Ar Al) + (3 x Ar S) + (12 x Ar O).
Mr Al2(SO4)3 = (2 x 27) + (3 x 32) + (12 x 16) = 54 + 96 + 192.
Mr Al2(SO4)3 = 342
Maka, Mr dari senyawa tersebut adalah 342
c. Mol
Mol merupakan jumlah tertentu untuk menyatakan banyaknya suatu zat yang berukuran mikroskopis (berukuran kecil).
Satu mol menunjukkan banyaknya partikel yang terkandung dalam suatu zat yang jumlahnya sama dengan jumlah partikel dalam 12 gram atom C-12.
Satu mol materi merupakan penyederhanaan jumlah partikel suatu ion, molekul, maupun unsur. Berikut persamannya.
1 mol = 1 L buah partikel zat
L: tetapan Avogadro = 6,02 x 1023
Sehingga, hubungan jumlah partikel dengan jumlah mol dapat dinyatakan dengan rumus sebagai berikut:
Jumlah mol = (Jumlah Partikel) / (6,02 x 1023 )
d. Massa Molar
Massa molar adalah massa 1 mol zat sebanyak Ar unsurnya atau Mr senyawanya yang dinyatakan dalam (gram/mol) Massa molar ditentukan dari masa atom relatif atau massa molekul relati
Berdasarkan hal di atas, dapat disimpulkan bahwa:
- Satu mol (n) setiap zat sama dengan massa zat yang nilainya sebesar bilangan Ar atau Mr zat tersebut dalam satuan gram
Nilai Ar atau Mr suatu zat menunjukkan massa zat yang mengandung jumlah partikel sebesar 6,02 x 1023 atau senilai satu mol
e. Konsep Kemolaran
Molaritas adalah jumlah mol zat terlarut dalam setiap 1 liter larutan. Konsep molaritas ini sering dikaitkan dengan stoikiometri larutan. Berikut ini rumus molaritas.
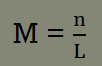
Dimana
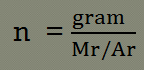
Keterangan:
M = kemolaran (mol/L)
n = mol yang di hasilkan (mol)
V = volum labu ukur (L)
e. Volume Molar Gas
Volume molar adalah penentuan mol suatu zat yang berfasa gas pada keadaan standar yaitu suhu 0 derajat celcius dan tekanan 1 atmosfer.
Volume molar gas terbagi menjadi dua diantaranya :
1. Keadaan standar
Volume molar adalah volume 1 mol gas pada keadaan standar (STP). STP adalah Standar suhu dan tekanan merupakan tekanan suatu gas 1 atmosfer (atm) atau 76 cmHg dengan suhu 273 K atau 0°C.
Setiap gas memiliki volume sama pada suhu dan tekanan yang sama berdasarkan hukum avogadro. Volume 1 mol gas adalah 22,4 liter pada keadaan standar.
Secara matematis, Volume molar dalam keadaan standard dirumuskan sebagai berikut:
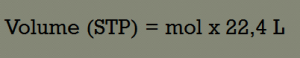
Contoh soal
Tentukan volume 0,25 mol gas oksigen pada keadaan STP?
Pembahasan:
V = mol x 22,4 L
= 0,25 x 22,4
= 5, 6 L
Jadi, volum 0,5 mol gas oksigen pada keadaan STP adalah 5,6 L
baca : Materi Kimia Larutan Elektrolit dan Non Elektrolit Kelas 10 SMA MA SMK
2. Keadaan tidak standar
Volume gas pada suhu dan tekanan tertentu (bukan 0°C, 1 atm) dapat dihitung berdasarkan persamaan gas ideal berikut ini, yakni:
![]()
Keterangan :
P = tekanan atau atm,
V = volume
T = suhu mutlak
n = jumlah partikel (mol),
R = tetapan gas (0,082 L atm mol-1 K-1)
Contoh Soal
Tentukan volume molar 34 gr gas ammonia (Mr = 17) yang diukur pada suhu 270C dan tekanan 1 atm.
Pembahasan
Diketahui :
massa Amonia = 34 gram
Mr Amonia = 17
Suhu =270C = (27+273) = 300 K
Tekanan (P) = 1 atm
Ditatanyakan volume molar (V) ?
Jawab
PV = nRT
n = gram/Mr
n = 34/17
n = 2 mol
maka :
PV = nRT
V = nRT/P
V = 2. 0,082. 300/1
V = 49,2 L
Demikian mengenai materi stoikiometri berikut penjelasannya. semoga bermanfaat