Titrasi Asam Basa, Pengertian, Rumus, dan Contoh Soalnya
Gurubagi.com.Titrasi merupakan suatu metode penambahan volume suatu larutan yang mengandung zat tertentu yang konsentrasinya diketahui terhadap larutan yang konsentrasinya tidak diketahui
Kadar atau konsentrasi larutan asam basa dapat ditentukan dengan metode volumetri dengan teknik titrasi asam basa.
Volumetri adalah teknik analisis kimia kuantitatif untuk menetapkan kadar sampel dengan pengukuran volume larutan yang terlibat reaksi berdasarkan kesetaraan kimia.
Kesetaraan kimia ditetapkan melalui titik akhir titrasi yang diketahui dari perubahan warna indikator dan kadar sampel ditetapkan melalui perhitungan berdasarkan persamaan reaksi.
Titrasi asam basa merupakan teknik analisisi untuk menentukan konsentrasi larutan asam atau basa. Reaksi yang terjadi merupakan reaksi asam basa(netralisasi).
Larutan yang konsentrasinya sudah diketahui disebut larutan baku. Di dalam titrasi terdapat istilah titik ekuivalen dan titik akhir titrasi.
Titik ekuivalen adalah titik ketika asam dan basa tepat habis bereaksi disertai denga perubahan warna indikatornya.
Baca : Latihan Soal Titrasi Asam Basa Kelas 11 SMA MA dan Kunci Jawabannya
Titik akhir titrasi adalah saat terjadinya perubahansifat fisis, misalkanwarnacampuran hasil reaksi atau adanya perubahan warna indikator. Titik akhir titrasi juga dapat ditunjuka dengan kenaikan atau penurunan pH secara tiba-tiba.
Perhitungan Kimia dalam Reaksi Larutan
1. Molaritas
Molaritas adalah konsentrasi larutan yang menyatakan banyaknya mol zat terlarut tiap 1 liter larutan. Molaritas dinotasikan dengan hurup M dengan rumus sebagai beriut

![]()
Keterangan :
M = molaritas
V = volume
Mr = massa molekul relatif
Jika pembilang dan penyebut pada persamaan tersebut dibagi 1000, nilai molaritas tidak berubah. Satuan mol/1000 dinamakan milimol (mmol) dan satuan L/1000 ut milliliter (mL)
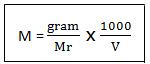
Contoh Soal
Jika 2 gram NaOH ( Mr = 40 ) dialrutkan ke dalam air dan memerlukan 100 ml larutan, H2SO4 0,4 M untuk menetralkanya. Tentukan kadar NaOH dalam cuplikan tersebut !
Untuk mencari kadar NaOH maka harus terlebih dahulu menacari molaritas NaOH dengan persamaan rumus berikut.
V1 . M1 . n1 = V2 .M2 . n2
100 . 0,4 . 2 = 100 . M2 .1
8 = 100 . M2
M = 0,08 M
Setelah itu, kita cari molaritas dari NaOH dengan menggunakan volume dari titrasi NaOH :
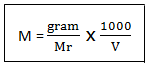
M = 2/40 x 1000/100 = 2000/4000 = 0,5 M
Setelah itu, kita bagi molaritas hasil titrasi dengan hasil dari pencarian molaritas biasa :
0,08 / 0,5 = 0,16 x 100 = 16 %
Sehingga di dapat persentase NaOH = 16%
2. Molalitas
Molalitas merupakan jumlah mol zat terlarut dalam 1 kg pelarut yang dinyatakan dalam satuan mol/kg. Molaritas secara matematis dirumuskan sebagai berikut :

Keterangan :
m = molalita larutan
P = massa pelarut (gram)
Mr Massa molekul relatif
3. Pengenceran
Pengenceran digunakan untuk menambahkan volume suatu larutan tanpa mengubah jumlah molnya.
V1 . M1 = V2 . M2
Keternangan
V1 = volume sebelum diencerkan
M1 = molaritas sebelum diencerkan
V2 = volume detelah diencerkan
M2 = molaritas setelah diencerkan
Contoh soal
Perhatikan kurva Titrasi larutan Asam Klorida dengan larutan NaOH di bawah ini!

Jika 15 ml larutan HCl diteteskan pada larutan NaOH 0,1 M , Tentukan konsentrasi larutan HCl yang dititrasi!
Rumus yang digunakan adalah
Vb . Mb . nb = Va . Ma . na
30 . 0,1 . 1 = 15 . Ma . 1
3 = 15 M2
Ma = 3/15 = 0,2 M
Sehinga konsentrasi HCl ada alh = 0,2 M
4. Pereaksi dan hasil reaksi
Sebagian senyawa lebih mudah bereaksi dalam bentuk karena larutan elektrolit tersebut mengalami reaksi ionisasi.
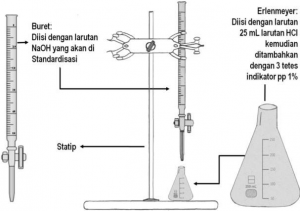
Juka kuantitas mol zat tertentu yang bereaksi menggunakan jumlah mola zat, dapat dihiyungh kuantitas zat lain dalam reaksi tersebut . Misalja titrasi 25 ml HCl 0,1 M pada saat penambahan NaOH 0,1 M
Banyaknya mol HCl mula-mula = 25 x 0,1 = 2,5 mm0l
Banyanya mol NaOH mula-mula = 10 x 0,1 mmol
Reaksi yang terdadi : HCl +NaOH → BaCl +H2O
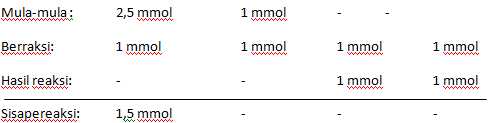
– –
Jadi mol pereaksi yang tersisa = 1,5 mmol = 1,5,10-3 mol HCl dan mol hasil reaksi yang terjasadi = 1 mmol = 1.10-3 mol.
Perhitungan Hasil Titrasi
Pada titrasi jumlah ekuivalen asam sama dengan jumlah ekuivalen bzsa sehinbgga dapat dirtulusan sebagai berikut
Ekuivalen asam = ekuivalen basa
VA . NA = VB . NB
Konsentrasi asam basa kemolaran (M) menjadi
VA . MA . nA = VB . Mb > nB
Keterangan :
VA = volume larutan asam
VB = Volume larutan basa
NA = noermalitas larutan asam
NB = normalita larutan basa
Ma =molaitas larutan asam
MB =cmolartas larutan basa
nA = valensi larutan asam
nB = valensi larutan basa
Contoh Soal
Contoh Soal
Jika sebanyak 40 mL larutan asam sulfat 0,25 M dititrasi dengan suatu basa bervalensi satu, dan ternyata dibutuhkan 57 mL basa tersebut. Tentukan kemolaran basa yang digunakan!
Pembahasan:
Reaksi netralisasi terjadi antara asam sulfat H2SO4 (asam kuat bervalensi dua) dengan suatu basa bervalensi satu.
Mb x Vb x na = Ma x Va X na
0,25 x 40 mL x 2 = Mb x 57 mL x 1
![]()
Mb = 0,35 M
Kurva titrasi asam basa
Cara menetukan atau menganalisis tikurva titrasi dan titik ekuivalen melalui titik akhir titrasi yaitu dengan dengan menghitung pH campuran reaksi pada beberapa titik yang berbeda selama perubahan larutan basanya.
Bentuk kurva titrasi tergantung pada kekuatan asam dan basa yang direaksikan pada saat melakukan peercobaan.
1. Titrasi asam kuat dengan basa kuat
Reaksi antara 25 mL HCl dan NaOH 0.1 M adalah sebagai berikut
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(aq)
Kurva sam kuat dengan baga kuat dapat dilihat pada gambit di bawah ini.

Garam NaCl yang terbentuk dari asam kuat dan basa kuat yang merupakan elektrolit kuat tidak akan terhidrolisis, karena larutannya bersifat netral (pH=7).
Indikator yang dapat digunakan adalah metil merah, bromtimol biru, dan fenolftalein (lebih tajam). Contoh: NaOH dengan HCl.
Contoh : NaCl(aq) → Na+(aq) + Cl–(aq)
Na+(aq) + H2O(l) →
Cl– (aq) + H2O(l) →
2. Titrasi Asam kuat dengan Basa Lemah
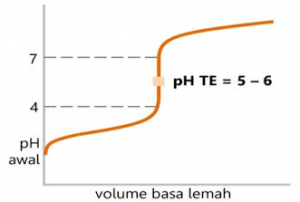
Pada percobaan ini asam kuat sebagai titrat (analit) biasa ditempatkan dalam labu Erlenmeyer dan basa lemah sebagai titran (titer) ditempatkan dalam buret.
Dimulai dari pH rendah menuju pH tinggi. Titik ekuivalen terjadi pada pH di bawah
Sebelum penambahan NH3, pH =1, setelah penambahan 10 ml NH3, pH =1,37, penambahan 25 ml NH3, pH=5,15 yang merupakan titik ekuivalen.
Penambahan 26 ml NH3, pH berubah sedikit, yaitu 6,1.Penambahan sedikit basa maka pH garam hamper tidak berubah, sehingga merupakan larutan penyangga.
Titik ekuivalen terjadi pada pH<7>karena garam yang terbentuk mengalami hidrolisis sebagian yang bersifat asam. Indikator yang dapat digunakan adalah metil merah.
NH4Cl(aq) → NH4(aq) + Cl–
NH4+(aq) + H2O(l) → NH4OH(aq) + H+(aq)
Cl–(aq) + H2O(l) →
3. Titrasi Asam Lemah dengan Basa Kuat
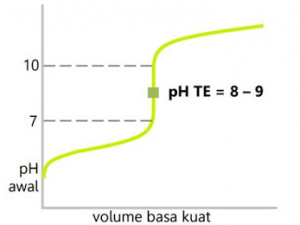
Penambahan 10 ml NaOH pH berubah menjadi 4,58, penambahan 25 ml terjadi titik ekuivalen Pada pH = 8,72.
Penambahan 26 ml NaOH pH =10,29. Pada grafik diatas, penambahan sedikit basa, maka pH akan naik sedikit, sehingga termasuk larutan penyangga.
Titik ekuivalen diperoleh pada pH >7. Hal itu disebabkan garam yang terbentuk mengalami hidrolisis sebagian yang bersifat basa. Indikator yang dapat digunakan adalah fenolftalein.
Contoh: CH3COOH dengan NaOH.
Reaksi antara 25 ml CH3COOH 0,1 M (Ka= 1,74.10-5) dengan NaOH 0,1 M adalah sebagai berikut :
Reaksi : CH3COOH(aq) +NaOH(aq) → CH3COONa(aq) + H2O(l).
CH3COONa(aq) → CH3COO–(aq) + Na+(aq)
CH3OO(aq) + H2O(l) → CH3OOH(aq) + OH–(aq)
Na+(aq) + H2O(l) →
4. Titrasi asam lemah dengan basa lemah
Ttrasi asam lemah dan basa lemah contohnya adalah yang biasa untuk kurva titrasi asam lemah dan basa lemah adalah asam etanoat dan amonia
CH3COOH (aq) + NH3(aq) → CH3COONH4(aq)
Hal ini juga terjadi karena keduanya bersifat lemah – pada kasus tersebut, titik ekivalen kira-kira terletak pada pH 7.
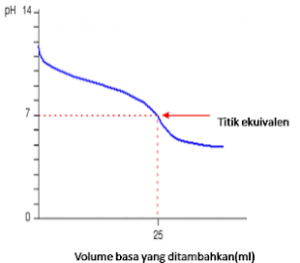
Gambar gravik diatas hanyalah penggabungan gambar yang telah anda lihat. Sebelum titik ekivalen sama seperti kasus amonia dengan HCl. Setelah titik ekivalen seperti bagian akhir kurva asam etanoat dengan NaOH.
Di dalam kurva tersebut terdapat “titik infleksi” atau titik kecuraman yang berkurang, berarti bahwa sulit melakukan titrasi antara asam lemah dengan basa lemah.
Untuk itu titrasi asam lemah menggunakan basa lemah dan sebaliknya tidak dilakukan karena:
1. Perubahan drastis pH terjadi sangat singkat.
2. Tidak ada indikator yang cukup teliti untuk mengamati perubahan.
3. Reaksi berlangsung lambat dan tidak tuntas.
Demikian pengertian titrasi asam basa, rumus, dan contoh soalnya. Semoga bermanfaat.



