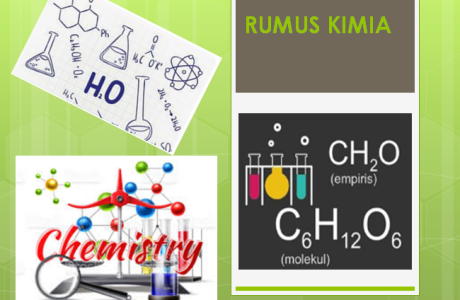
Pengertian Rumus Empiris, Contoh Soal dan Pembahasannya
Gurubagi.com. Secara garis besar, rumus empiris merupakan perbandingan paling sederhana dari atom-atom penyusun suatu senyawa.
Dengan kata lain rumus empiris adalah rumsu yang menunjukan jenis dan perbandingan paling sederhana dari atom-atom penyusun zat.
Rumus kimia senyawa ion merupakan rumus empiris. Misalnya, natrium klorida merupakan senyawa ion yang terdiri atas ion Na+ dan ion Cl– dengan perbandingan 1:1. Rumus kimia natrium klorida adalah NaCl.
Pada kondisi lain, sebagian unsur-unsur ada yang membentuk molekul-molekul, sehingga, semua senyawa yang memiliki rumus molekul, pasti memiliki rumus empiris.
Baca : Pengertian Rumus Molekul, Soal dan Pembahasannya
Sedangkan senyawa yang memiliki rumus empiris, belum tentu memiliki rumus molekul. Perhatikan perbedaan rumus empiris dan rumus molekul dari contoh dibawah ini.
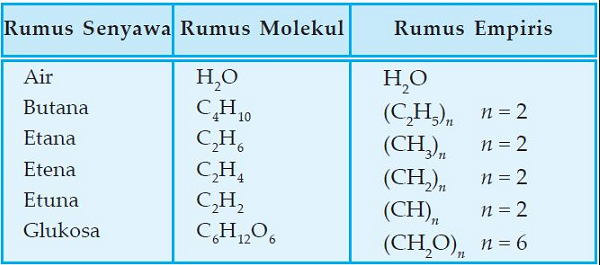
Dari contoh diatas H2O (air) karena rumus molekunya sudah dengan perandingan yang sederhana, maka rumus molekulnya sama dengan rumus empirisnya.
Sedangkan untuk rumus molekul C4H10 masih dapat disederhanakan menjadi dengan rumus empiris C2H5.
Berdasarkan komponen penyusun yang diketahui dapat dihitung dan ditentukan rumus empirisnya. Rumus empiris dapat ditentukan dengan menghitung mol komponen penyusun zat dengan menggunakan massa molar.
Untuk menentukan rumus empiris suatu senyawa yang terdiri dari dua unsur digunakan rumus sebagai berikut :
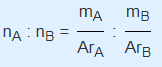
Keterangan :
- nA adalah jumlah mol unsur A
- nB adalah jumlah mol unsur B
- mA adalah massa unsur A
- ArA adalah massa atom relatif unsur A
- ArB adalah massa atom relatif unsur B
Atau rumus di atas dapat juga diekspresikan dalam persamaan :

Jika di dalam rumus senyawa terdapat tiga unsur pembentuknya, maka kita harus membandingkan ketiga-tiga unsur tersebut untuk mendapatkan rumus empirisnya. Sehingga rumus empirisnya dapat kita tulis secara matematis adalah :
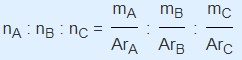
Keterangan :
- nA adalah jumlah mol unsur A
- nA adalah jumlah mol unsur B
- nC adalah jumlah mol unsur C
- mA adalah massa unsur A
- mB adalah massa unsur B
- mC adalah massa unsur C
- ArA adalah massa atom relatif unsur A
- ArB adalah massa atom relatif unsur B
- ArC adalah massa atom relatif unsur C
Contoh Soal rumus empiris dan pemabahasannnya
soal nomor 1
Jika suatu sampel senyawa mengandung 27 gram unsur aluminium(Al) dan 24 gram unsur oksigen (O). Maka tentukanlah rumus empirisnya! (Ar Al = 27 dan O = 16)
Pembahasan :
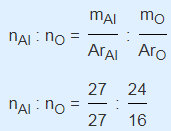
nAl : nO
(1 : 1,5′) x 2
2 : 3
Jadi, rumus empiris sampel senyawa tersebut adalah Al2O3.
Soal nomor 2
Apabila sebuah senyawa memiliki 5,27 mol C, 5,2 mol H, dan 1,32 mol O, sedangkan Mr nya adalah 136, tentukan rumus empiris dan rumus molekulnya!
Pembahasan :
Kita bisa tentukan dengan perhitungan seperti ini.
nC : nH : nO
= 5,27 : 5,2 : 1,32
= 3,99 : 3,93 : 1 (pembagian dengan 1,32)
= 4 :4 : 1 (pembulatan)
Maka rumus empirisnya yaitu C4H4O.

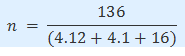
n = 2
Maka rumus molekulnya yaitu (C4H4O)2=C8H8O2
Soal nomor 3
Suatu Oksida nitrogen mengandung 36.37% massa oksigen (Ar N = 14, Ar O = 16), maka rumus emiris oksida tersebut adalah …..
Pembahasan :
hitung perbnadingan mol N dengan O terlebih dahulu dengan cara sebagai berikut :
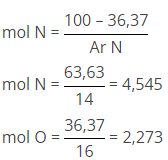
nN : nO
4,545 : 2,273
2 : 1
Sehingga rumus empiris senyawa oksida nitrogen adalah N2O
Soal nomor 4
Pembakaran hidrogen menghasilkan 220 g CO2 dan 45 g H2O, maka rumus empiris senyawa tersebut adalah.
Pembahasan :
Mencari massa masing- masing unsur dengan car asebagai berikut
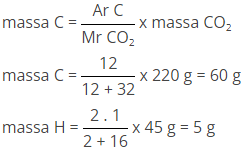
Mencari mol masing-masing unsur dengan cara:
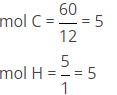
Kemudian mencari perbandingan mo masing-masing dengan cara
nC : nH
5 : 5
1 : 1
Maka rumus empiris senyawa tersebut adalah CH
Demikian pengertian rumus empiris, contoh soal dan pembahasannya. Semoga bermanfaat.