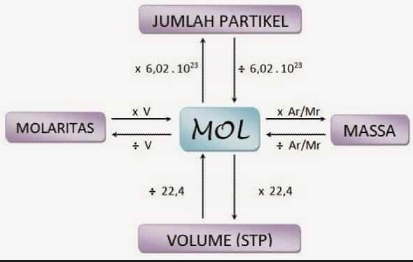
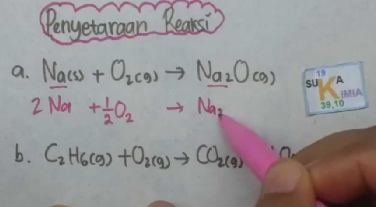Stoikiometri : Kadar Zat dalam Campuran, Rumus, dan Penerapan Soal
Gurubagi.com. Kadar zat di dalam campuran atau suatu produk dapat kita ketahui dengan cara mengitungnya. Zat kimia memiliki banyak kegunaan, akan tetapi juga memiliki dampak buruk bagi kehidupan jika digunakan berlebih.
Suatu produk atau campuran dapat tersusun oleh beberapa zat kimia. Di dalam campuran terdapat zat terlarut dan zat pelarut.
Zat terlarut, yaitu yang memiliki jumlah lebih banyak dari pada zat pelarut. Materi ini termasuk kedalam bagian materi stoikiometri
Kandungan zat terlarut di dalam suatu senyawa atau produk dapat kita hitung dengan cara menentukan kadar zat dalam campuran. Kadar campuran suatu zat menyatakan banyaknya zat terlarut dalam campuran atau senyawa tersebut.
Kadar zat dalam campuran dapat dinyatakan dalam persen massa (% massa) atau persen volume (% volume) atau per satu juta (bpj atau ppm = part per milion), molalitas, molaritas dan fraksi mol.
Baca :
- Materi Stoikiometri Kelas 10 SMA SMK : Hukum Dasar Kimia
- Materi Stoikiometri : Konsep Mol Beserta Penerapan Soalnya
- Stoikiometri : Massa Atom Relatif (Ar) dan Massa Molekul Relatif (Mr)
Rumus Kadar Zat alam campuran
Berikut ini adalah rumus untuk mencari kadar zat campuran.
1. Presentase Massa
Presentase massa, yaitu massa (gram) zat dalam setiap 100 gram campuran.

Contoh penerapan soal :
Sebanyak 25 gram gula (C₁₂H₂₂O₁₁) dilarutkan dalam 100 gram air (H₂O), maka htunglah kadar gula (C₁₂H₂₂O₁₁) dalam larutan!
Pembahasan:

Massa C₁₂H₂₂O₁₁ = 25 gram
Massa H₂O = 100 gram
Maka kadar C₁₂H₂₂O₁₁ adalah :
% C₁₂H₂₂O₁₁ = (massa C₁₂H₂₂O₁₁ / massa larutan) × 100
% = (25 gram / 125 gram) × 100 = 0,2 × 100
= 20%, sehingga kadar gula (C₁₂H₂₂O₁₁) dalam larutan adalah 20%.
2. Pesentase volume
Presentase volume , yaitu volume (ml) zat dalam setiap campuran.

Contoh penerapan soal :
Anik membuat sirop buah dengan ukuran sirup 10 ml yang di campur air sebanyak 250 ml, maka hitunglah persentase sirup dalam larutan!
Pembahasan:
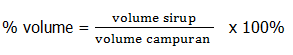
% sirup = 10/260
% sirup = 0,04, sehingga kadar sirup dalam larutan adalah 0,04%
3. Bagian per juta atau Part per million (bpj atau bpm)
Bpj adalah bagian per juta atau part per million (ppm), yaitu massa (mg) zat dalam setiap 1 kg campuran.
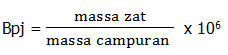
Contoh penerapan soal :
Di dalam 100 ml sirop obat batuk, terdapat 0,5 mg. Jika massa sirop obat tersebut 125 gram. Tentukan kadar vitamin C (Bpj) dalam obat batuk tersebut!.
Pembahasan:
Massa vitamin C = 0,5 mg = 0,0005 gram
Massa obat = 125 gram
![]()
![]()
Bpj = 4, jadi, kadar vitamin C dalam sirop obat batuk adalah 4 Bpj.
4. Molaritas (M)
Molaritas adalah banyaknya suatu zat dalam setiap liter campuran. Untuk mencari molaritas suatu zat dapat menggunakan beberapa persamaan berikut ini, tergantung besaran mana yang diketahui.
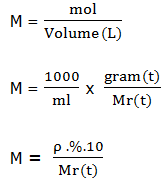
Contoh penerapan soal :
Sebanyak 0,2 mol NaOH dilarutkan dalam air sampai volume larutan menjadi 4 liter, maka hitunglah molaritas larutan tersebut!
Pembahasan :
Di dala soal tersebut, yang menjadi zat terlarut adalah NaOH sedangkan pelarutnya adalah air, sehingga :
Mol (t) = 0,2 mol
Volume larutan = 4 liter
M = mol/volume
M = 0,2 mol/4 = 0,05 Molar
4. Molalitas (m)
Molaritas (m) adalah jumlah mol zat dalam setiap kg campuran.
![]()
Contoh Penerapan
Sebanyak 0,4 mol glukosa dilarutkan dalam 500 gram air. Hitunglah molalitas larutan tersebut!
Pembahasan:
Mol (t) = 0,4 mol
Massa pelarut = 500 gram = 0,5 Kg
m = mol (t)/Kg (p)
= 0,4/0,5 = 0,8 molal, sehingga molalitas larutan adalah 0,8 m
5. Fraksi Mol (X)
Fraksi mol, yaitu mol suatu zat dibagi jumlah mol seluruh zat dalam campuran.
![]()
Contoh penerapan soal :
Hitunglah fraksi mol masing-masing komponen larutan jika 30 gram urea (Mr = 60) dilarutkan dalam 90 gram air!.
Pembahasan :
Zat terlarut adalah urea, sedangkan zat pelarutnya adalah air, sehingga menggunakan persamaan berikut.
Massa urea= 30 gram
Mr urea = 60
Masa air = 90 gram
Mr air = 18
Berikutnya mencari mol zat pelarut (air) dan zat pelarut, dengan persamaan berikut.
Zat terlarut (urea)
![]()
![]()
= 0,5 mol, sehingga mol zat terlarut adalah 0,5 mol
Zat pelarut (air)
![]()
Maka mol pelarut adalah 0,5 mol.
Menentukan fraksi mol masing-masing zat menggunakan persaman berikut:
![]()

Maka didapat fraksi mol zat terlarut (urea) = 0,09 dan fraksi mol zat pelarut (air) = 0,91.
Demikian ulasan mengenai materi stoikiometri : kadar Zat dalam campuran, rumus dan penerapan soal. Semoga bermanfaat.