Sifat Periodik Unsur : Pengertian dan Penjelasannya
Gurubagi.com. Di dalam pelajaran kimia terdapat materi mengenai unsur-unsur yang teradpat di muka bumi yang tersusun dalam tabel Sistem Periodik Unsur (SPU) dan memiliki sifat keperiodikan unsur.
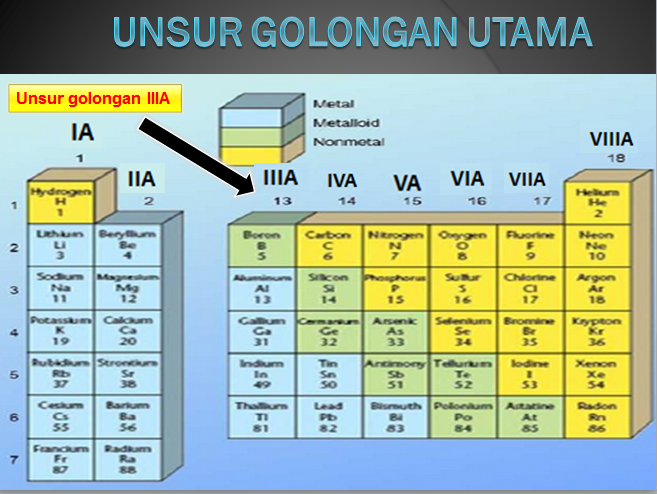
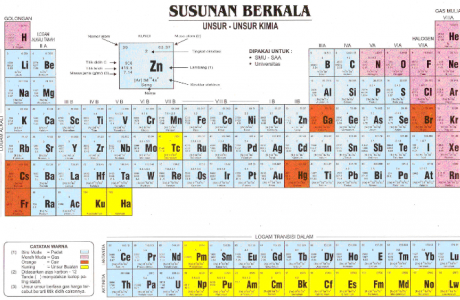
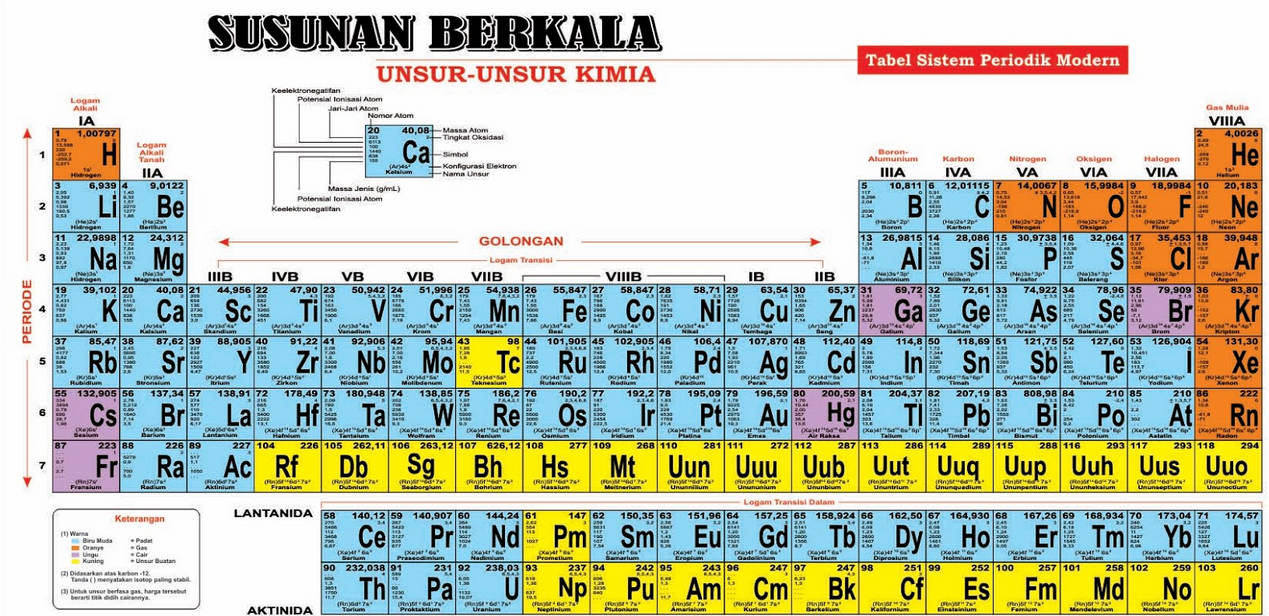
Pada tabel sistem periodik unsur ini, unsur di kelompokan berdasarkan golongan dan periode. Golongan (kolom vertikal) ditulis dengan urutan bilangan romawi dan periode (lajur horizontal).
Perhatikan unsur yang terdapat dalam tabel Sistem Periodik Unsur.
Berikut adalah hal-hal yang perlu diketahui tentang sistem periodik unsur kimiadi atas .
Unsur-unsur pada golongan A merupakan golongan utama, sedangkan golongan B dinamakan logam transisi. Dua deret dari bagian bawah merupakan logam transisi dalam yang terdiri atas lanthanide dan aktinida.
- Golongan IA (alkali, kecuali H), terdiri dari H, Li, Na, K, Rb, Cs, Fr;
- Golongan IIA (alkali tanah), terdiri dari Be, Mg, Ca, Sr, Ba, Ra;
- Golongan VIIA (halogen), terdiri dari F, Cl, Br, I, At;
- Golongan VIIIA (gas mulia), terdiri dari He, Ne, Ar, Kr, Xe, Rn;
- Golongan IIIA (boron-aluminium), terdiri dari B, Al, Ga, In, Ti;
- Golongan IVA (karbon-silikon), terdiri dari C, Si, Ge, Sn, Pb;
- Golongan VA (nitrogen-fosforus), terdiri dari N, P, As, Sb, Bi;
- Golongan VIA (oksigen-belerang), terdiri dari O, S, Se, Te, Po;
- Golongan IB sampai dengan VIIIB disebut golongan transisi.
Sementara itu, periode adalah barisan horizontal yang terdapat pada tabel periodik. Terdapat 7 periode dalam tabel periodik, di mana masing-masing tabel mewakili tingkat energi atom yang dimiliki.
Tidak semua periode memiliki jumlah unsur yang sama. Di mana jumlah unsur terkecil terdapat pada periode 1 yang berjumlah 2 unsur.
Sedangkan jumlah unsur tebanyak adalah pada periode 6 yang memiliki 32 unsur.
- Periode ke-1, 2 unsur
- Periode ke-2, 8 unsur
- Periode ke-3, 8 unsur
- Periode ke-4, 18 unsur
- Periode ke-5, 18 unsur
- Periode ke-6, 32 unsur, 18 unsur seperti periode ke-4 dan ke-5, 14 unsur deret lantanida
- Periode ke-7, merupakan periode unsur yang belum lengkap. Terdapat deret aktinida
Sifat Periodik Unsur
Berdasarkan sifatnya unsur-unsur dalam tabel sistem periodik unsur kimia terbagi ke dalam tiga jenis yaitu logam, nonlogam, dan metalloid.
Logam memiliki sifat yang cenderung melepaskan elektron dari nonlogam untuk membentuk ion positif.
Baca : Penjelasan Golongan A dan B Dalam Tabel Sistem Periodik Unsur
Sedangkan nonlogam cenderung menerima elektron dari logam. Lain halnya dengan unsur metalloid, yang memiliki kedua sifat seperti logam dan nonlogam. Berikut ini penjelasan dari sifat periodik unsur.
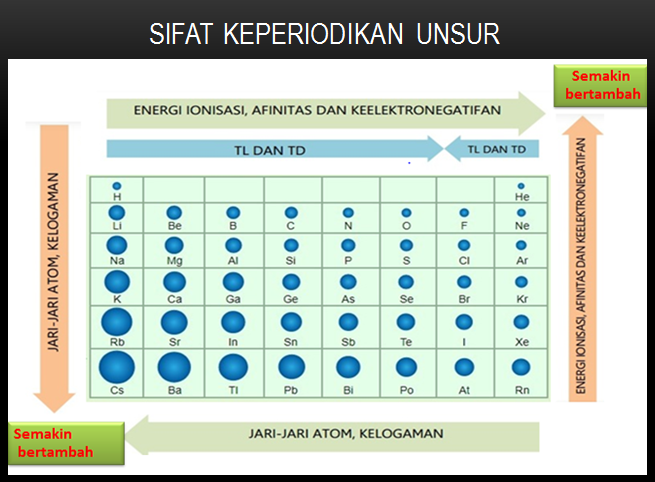
1. Jari-Jari Atom
Jari-jari atom adalah jarak dari inti atom ke orbital elektron terluar yang stabil dalam suatu atom dalam keadaan setimbang.
Jarak tersebut dapat diukur dalam satuan pikometer atau angstrom. Dalam satu golongan dari atas ke bawah, jari-jari atom cenderung membesar setara dengan pertambahan pada kulit elektron.
2. Energi Ionisasi
Energi ionisasi adalah jumlah energi yang dibutuhkan untuk melepaskan suatu elektron dalam atom.
Dalam tabel periodik unsur, energi ionisasi unsur meningkat dari bawah ke atas. Hal tersebut dikarenakan makin sedikit elektron, maka makin kuat ikatannya
3. Afinitas Elektron
Afinitas elektron adalah jumlah energi yang dilepaskan ketika sebuah elektron ditambahkan ke dalam kolom atom netral untuk membentuk ion negatif.
Sifat nonlogam memiliki nilai lebih tinggi pada afinitas elektron daripada sifat logam. Dan afinitas elektron secara umum terus meningkat sepanjang periode.
4. Keelektronegatifan
Keelektronegatifan merupakan kemampuan atau kecenderungan suatu atom untuk menangkap ataupun menarik kembali elektron dari atom lainnya.
Unsur-unsur dalam satu golongan, semakin ke bawah elektronegatifnya akan semakin kecil. Hal ini terjadi karena gaya tarik inti yang makin lemah sehingga sukar menarik elektron dari luar.
Unsur-unsur dalam satu periode, elektronegatifnya semakin ke kanan akan semakin besar. Hal ini terjadi karena gaya tarik inti yang makin kuat sehingga mudah menarik elektron dari luar.
5. Sifat Logam
Sifat logam adalah mengilap, mengantarkan listrik, dapat ditempa menjadi lempengan tipis, dapat direntangkan menjadi kawat, dan cenderung menangkap elektron.
Sifat-sifat periodik unsur berdasarkan sifat logamnya sebagai berikut.
a. Sifat logam pada unsur-unsur satu golongan pada tabel sistem periodik, semakin ke bawah semakin besar karena makin mudah melepaskan elektron (gaya tarik inti semakin lemah).
b. Sebaliknya, dalam satu periode, semakin ke kanan sifat logamnya akan semakin berkurang karena semakin sulit melepaskan elektron.
6. Titik Leleh dan Titik Didih
Titik leleh dan titik didih untuk unsur logam, ditentukan dari ikatan logam, sedangkan untuk unsur non logam ditentukan oleh gaya Van Der Waals, dan memiliki kecenderungan sebagai berikut
a. Dalam suatu golongan, dari atas ke bawah, memiliki 2 jenis kecenderungan, dimana unsur dari golongan IA – IVA memiliki titik leleh dan didih yang semakin rendah, dan unsur dari golongan VA-VIIIA memiliki titik leleh dan didih yang semakin tinggi.
b. Dalam suatu periode, dari kiri ke kanan, juga memiliki 2 jenis kecenderungan, dimana titik leleh dan titik didih semakin tinggi sampai dengan golongan IVA, dan kemudian turun drastis, menjadi titik leleh dan titik didih semakin rendah sampai dengan golongan VIIIA.
Demikian pengertian sifat periodik unsur dan penjelasannya. Semoga bermanfaat