Struktur Atom, Perkembangan Teori Atom, dan Partikel Penyusunnya
Gurubagi.com. Sejarah perkembangan teori atom sudah ada sejak sebelum Masehi. Teori atom tidak bisa dilepaskan dari pembahasan mengenai struktur atom.
Struktur atom merupakan satuan dasar materi yang terdiri dari inti atom beserta awan elektron bermuatan negatif yang mengelilinginya. Inti dari atom tersebut memiliki kandungan campuran.
Campuran yang terdapat dalam inti atom adalah proton yang bermuatan positif dan neutron yang bermuatan netral. Elektron berada mengelilingi inti atom terikat, karena adanya gaya elektromagnetik
Struktur atom mengalami perkembangan dari waktu ke waktu secara signifikan, mulai dari teori atom yang sederhana, hingga teori-teori yang berkembang secara modern.
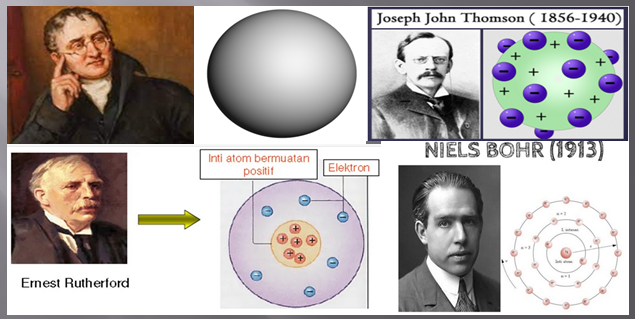
Perkembangan Teori Atom
Berikut ini adalah tokoh-tokoh yang berperan penting dalam perkembangan teori atom.
1. Teori Atom Dalton
John Dalton pada tahun 1803 mengemukakan dua hukum, yaitu hukum kekekalan massa (hukum Lavoisier) dan hukum susunan tetap (hukum Proust).
Sebelumnya, Lavoisier mengatakan bahwa massa total dari zat-zat sebelum reaksi akan selalu sama dengan massa total dari zat-zat yang hasili reaksi.
Sedangkan Proust mengatakan bahwa perbandingan massa pada unsur-unsur dalam suatu senyawa senantiasa akan selalu tetap.
Berdasarkan kedua hukum tersebut, John Dalton kemudian mengemukakan pendapatnya terkait Teori Atomnya sebagai berikut.
a. Atom merupakan bagian terkecil dari sebuah materi dan tidak dapat dibagi lagi menjadi bagian lain.
b. Atom merupakan gambaran bola pejal yang sangat kecil.
c. Atom-atom bergabung untuk membentuk sebuah senyawa dengan perbandingan bilangan bulat serta sederhana. Di dalam hal ini, misalkan air yang terdiri dari atom-atom hidrogen dan atom-atom oksigen.
Teori Atom Dalton menjadi awal perkembangan dalam dunia pengetahuan mengenai atom, sehingga membangkitkan minat terkait penelitian mengenai beragam jenis modal atom.
Akan tetapi teori atom Dalton ini masih memiliki beberapa kelemahan. Adapun beberapa kelemahan dari teori Dalton adalah sebagai berikut.
a. Belum menjelaskan bagaimana cara atom tersebut saling berkaitan
b. Belum menunjukan hubungan antara larutan senyawa dengan daya hantar sebuah arus listrik karena atom merupakan bagian terkecil unsur atau benda yang tidak bisa dibagi lagi
C. Tidak menjelaskan sifat listrik materi
d. Tidak menjabarkan perbedaan antara atom unsur yang satu dengan atom unsur lainnya.

2. Teori Atom Thomson
Teori Thomson melakukan perbaikan terkait kelemahan yang terdapat dalam teori Dalton. Thomson melakukan eksperimen dan penemuan elektron tahun 1897. Di dalam hal ini, elektron merupakan partikel yang bermuatan negatif.
Thomson melakukan eksperimen melalui sebuah percobaan dengan menggunakan tabung sinar katode. Berdasarkan percobaan tersebut, Thomson menyimpulkan bahwa sinar katode merupakan sebuah partikel,karena dapat memutar baling-baling yang terletak antara anode dan katode.
Partikel tersebut merupakan partikel penyusun atom yang bermuatan negatif, yang kita namakan elektron.
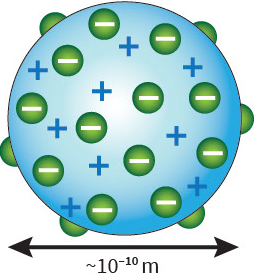
Teori Thomson juga terkenal dengan sebutan Teori Roti Kismis, yaitu sebuah bola pejal yang memiliki muatan positif di dalamnya tersebar elektron yang memiliki muatan negatif.
Baca :
- Struktur Atom : Nomor Atom, Nomor Massa, Isotop, dan Contoh Soalnya
- Contoh Soal Kimia Struktur Atom Kelas 10 SMA MA dan Kunci Jawabannya
- Latihan Soal Struktur Atom Kimia Kelas 10 SMA MA dan Jawabannya
- Latihan Soal Struktur Atom Kimia Kelas 10 SMA MA Kurikulum 2013
- Contoh Soal Kimia Struktur Atom Kelas 10 SMA MA Kurikulum 2013
Thomson memiliki beberapa kelebihan dari pada teori Dalton, karena Thomson dapat membuktikan bebera hal dari teori Dalton.
Berikut ini adalah kelebihan dari teori atom Thomson
a. Atom bukan merupakan bagian terkecil dari suatu unsur, karena adanya partikel lain yang bermuatan negatif dan terdapat pada atom.
b. Atom bersifat netral yang tersusun dari partikel-partikel yang memiliki muatan positif dan negatif.
c. Membuktikan bahwa adanya elektron dalam semua unsur benda.
Akan tetapi, Teori Atom Thomson juga memiliki beberapa kekurangan. Kekurangan dari teori ini adalah sebagai berikut,
a. Tidak dapat menjelaskan tentang susunan muatan positif dan jumlah elektron yang terdapat dalam bola
b. Tidak dapat menjelaskan tentang inti dari atom.
3. Teori Atom Rutherford
Teori Rutherford berdasarkan pada eksperimen dengan melakukan penembakan partikel alfa terhadap lempeng emas.
Eksperimen tersebut kemudian terkenal dengan nama eksperimen Geiger-Marsden, yang merupakan murid dari Rutherford. Mereka melakukan percobaan dengan menembakkan partikel atau sinar alfa terhadap lempeng tipis emas.
Partikel alfa sendiri merupakan partikel yang memiliki muatan positif, bergerak lurus serta memiliki daya tembus yang besar. Berdasarkan percobaan tersebut, mereka menemukan bahwa sinar alfa ada yang dibelokkan, dipantulkan dan diteruskan.
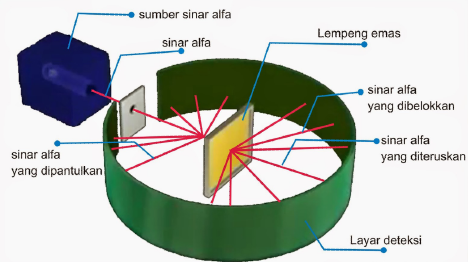
Hasil percobaan tersebut kemudian berkembang lagi menjadi sebuah hipotesis teori Atom Rutherford yang menyatakan beberapa hal sebagai berikut.
a. Elektron yang memiliki muatan negatif bergerak mengelilingi inti atom yang bermuatan positif dengan kecepatan yang sangat tinggi
b. Atom memiliki inti atom yang bermuatan positif menjadi pusat massa atom
c. Penyebaran partikel alfa tidak terpengaruh oleh adanya awan elektron
d. Sebagian besar dari atom merupakan permukaan yang kosong atau hampa
e. Sebagian kecil dari partikel alfa yang lewat akan dibelokkan dan sedikit sekali yang dipantulkan sedangkan sebagian besar lainnya tidak mengalami hambatan.
Teori Atom Rutherford memiliki beberapa kelebihan, yaitu sebagai berikut.
a. Menggambarkan serta menjelaskan bentuk lintasan elektron yang mengelilingi inti dari atom.
b. Memberikan kesimpulan bahwa atom tersusun dari inti serta elektron yang mengelilinginya satu sama lain terpisah oleh ruang hampa
c. Dapat menjelaskan pergerakan elektron di sekitar atom.
Akan tetapi, teori atom Rutherford juga masih memiliki beberapa kekurangan diantaranya sebagai berikut.
a. Tidak dapat menjelaskan kenapa elektron tidak pernah jatuh ke dalam inti atom sesuai dengan teori fisika klasik, dan spektrum garis pada atom hgidrogen
b. Tidak mampu menjabarkan terkait spektrum garis pada atom hidrogen
c. Belum dapat menenentukan letak dari elektron dan cara rotasinya terkait inti atom
d. Tidak dapat menjelaskan mengapa elektron yang bergerak akan memancarkan energi, sehingga secara keseluruhan energi atom tidak stabil.
4. Teori Atom Bohr
Pada tahun 1913, seorang pakar fisika dari Denmark, yaitu Bohr melakukan eksperimen yang terkenal dengan nama spektrum atom hidrogen.
Eksperimennya bertujuan untuk menyempurnakan capaian dalam teori atom Rutherford yang sudah muncul sebelumnya.
Eksperimen ini berhasil menggambarkan keadaan elektron. Penjelasan teori oleh Bohr mengenai atom hidrogen adalah gabungan dari teori klasik yang berasal dari teori atom Rutherford dan teori kuantum oleh Planck.
Adapun hipotesis dari Bohr terkait hasil eksperimennya, menyatakan sebagai berikut.
a. Elektron beroindah dari orbit satu ke orbit yang lain berdasarkan tingkatan energi.
b. Berpindahnya elektron menuju ke orbit yang memiliki energi lebih tinggi, jika elektron menyerap energi yang memiliki besaran sama dengan perbedaan energi antara dua orbit yang bersangkutan.
c. Elektron berpindah ke orbit yang memiliki energi lebih rendah akan memancarkan radiasi yang teramati sebagai spektrum garis yang besarnya sama dengan perbedaan energi antara kedua orbit yang bersangkutan.
d. Elektron pada keadaan stationer dan tidak memancarkan energi selama dalam orbitnya.
e. Perpindah elektron menempati orbit yang lebih tinggi, maka atom dalam molekul berada dalam tingkat tereksitasi.
f. Elektron yang berpindah dan menempati orbit yang lebih rendah, maka atom dan molekul berada dalam tingkat dasar.
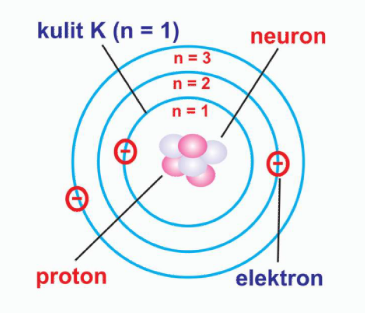
f. Elektron mengelilingi inti atom dalam orbit tertentu yang berbentuk lingkaran atau kulit elektron, dinyatakan dalam bentuk notasi K, L, M, N dan seterusnya.
g. Energi elektron pada masing-masing orbit dapat mempengaruhi besar kecil lingkaran orbit.
Teori Bohr memiliki beberapa kelebihan, yaitu sebagai berikut.
a. Dapat menjelaskan tentang spektrum atom hidrogen secara akurat
b. Membuktikan adanya lintasan elektron untuk atom hidrogen
c. Memperbaiki kelemahan dari Teori Atom dari teori Rutherford.
Teori Bohr juga masih memiliki beberapa kekurangan sebagai berikut.
a. Sedikit menjelaskan mengenai spektrum warna dari atom yang memiliki banyak elektron atau yang lebih kompleks
b. Tidak dapat menjelaskan tentang adanya garis halus dalam spektrum hidrogen karena elektron dianggap sebagai partikel
c. Model atom Bohr memiliki nilai momentum sudut lintasan ground state yang salah
d. Tidak bisa mengetahui intensitas relatif dari garis spektrum
e. Tidak bisa menjelaskan atom selain atom hidrogen.
5. Teori Atom Modern
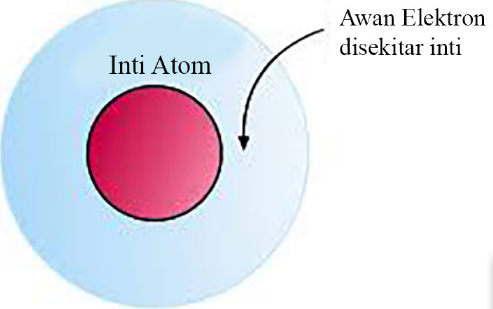
Pencetus teori atom modern atau teori atom mekanika kuantum, yaitu oleh Edwin dan Werner. Dasar dari teori ini adalah gerakan elektron dalam mengelilingi inti bersifat layaknya sebuah gelombang.
Hingga saat ini, teori ini merupakan teori paling mutakhir terkait atom. Adapaun teori model atom modern berdasarkan pendapat para ahli, sebagai berikut.
a. Louis de Brouglie, bahwa elektron bersifat gelombang dan partikel.
b. Werner Heisenberg, dengan asas ketidakpastian bahwa ruang sekitar ini dapat menemukann elektron yang benama orbital.
c. Edwin Schordinger, mengenai persamaan gelombang elektron dalam atom.
Berdasarkan pernyataan diatas, maka kesimpulan teori model atom modern adalah sebagai berikut.
a. Elektron-elektron mengitari inti atom dan berada pada orbital-orbital tertentu yang membentuk kulit atom.
b. Orbital merupakan ruang yang berada pada sekitar inti tempat elektron dapat ditemukan.
c. Kedudukan elektron pada orbital-orbitalnya dinyatakan dengan bilangan kuantum.
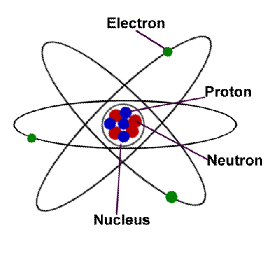
Partikel Penyusun Atom
Atom merupakan partikel terkecil dari suatu unsur, bersifat netral secara elektrisitas tersusun atas inti pusat yang bermuatan positif dan dikelilingi oleh satu atau lebih elektron yang bermuatan negatif.
Atom terdiri dari berbagai partikel dasar penyusunnya, yaitu proton, elektron, dan neutron. Untuk mengetahuinya lebih lanjut kita simak penjelasan berikut.
1. Elektron
Elektron merupakan partikel dalam atom pertama kali ditemukan oleh fisikawan asal Inggris, J.J Thomson pada tahun 1897.
Penemuan elektron berkaitan dengan percobaan tentang hantaran listrik melalui tabung hampa, Thomson melakukan percobaan dengan sinar katode.
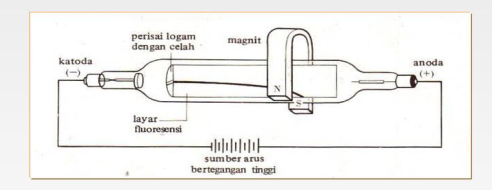
Eksperimennya dengan mengamati dua pelat elektrode dalam tabung vakum. Ketika dua pelat elektrode tersebut terhubungkan dengan sumber tegangan tinggi, dari elektrode negatif (katode) menjalar sinar menuju ke elektrode positif (anode), maka sinar yang keluar dari katode (sinar katode) dan tabung vakum atau tabung sinar katode.
Kesimpulan dari eksperimen ini, bahwa sinar katode yang dibelokan oleh muatan listrik ke arah kutub positif merupakan partikel yang bermuatan listrik negatif.
J.J Thomson menggunakan sifat ini untuk menghitung rasio muatan/ massa untuk sebuah electron. Rumus perbandingan harga muatan negative eletron terhadap massanya, yaitu:
e/m = -1,76 x 108 coulomb/g
keterangan :
e = muatan electron dalam satuan coulomb
m = massa electron dalam satuan gram
Akan tetapi, pada tahun 1909 R.A. Milikan merancang metode yang terkenal sebagai percobaan tetes minyak untuk menentukan muatan pada elektron. Ia menemukan muatan pada elektron adalah 1,6 × 10–19 C.
2. Proton
Eugen Goldstein pada tahun 1886 dengan percobaan menggunakan tabung sinar katode, menemukan partikel jenis baru dari atom yang disebut sinar terusan atau sinar positif (sinar anode).
Hasil percobaan menunjukan sinar katode merupakan radiasi partikel yang bermuatan positif, sinar anode bergantung pada jenis gas dalam tabung.
3. Neutron
Pada tahun 1920, Rutherford mengajukan hipotesis bahwa dalam inti atom harus ada pertikel tidak bermuatan yang massanya hampir menyerupai massa proton.
Hipotesisi Rutherford berhasil James Chadwik buktikan dengan eksperimen dengan menembaki atom berilium dengan sinar alfa.
Hasil penembakan tersebut terdeteksi partikel tidak bermuatan yang memiliki massa yang hampir sama dengan proton.
Neutron bersifat netral dan tergolong partikel dasar karena semua atom mengandung partikel tersebut kecuali isotop hidrogen.
Demikian ulasan materi struktur atom, perkembangan teori atom, dan partikel penyusunnya. Semoga bermanfaat.