Pengertian Senyawa Kovalen Polar dan Nonpolar Serta Perbedaannya
Gurubagi.com. Senyawa polar dan nonpolar dalam suatu ikatan antaratom terjadi akibat adanya perbedaan keelektronegatifan antara dua atom tersebut.
Kelektronegaifan unsur merupakan kecenderungan suatu atom untuk bermuatan negatif atau menarik elektron dari atom lain untuk berikatan bersama oleh kedua atom tersebut.
Senyawa polar terbentuk dari ikatan kimia dengan nama ikatan kovalen polar, sedangkan senyawa nonpolar terbentuk dari ikatan kovalen nonpolar.
1. Senyawa Polar
Ikatan kovalen polar adalah ikatan yang pasangan elektron ikatannya cenderung tertarik ke salah satu atom yang berikatan.
Suatu ikatan kovalen bersifat polar apabila distribusi elektron ikatan yang ada tidak persis terletak di tengan-tengah kedua atom yang berikatan. Ikatan ini terbentuk dari atom-atom karena adanya perbedaan keelektronegatifan yang relatif besar.
Atom yang lebih kuat menarik elektron ikatan akan memiliki muatan negatif sebagian (parsial negatif), sedangkan atom yang lebih lemah dalam menarik elektron ikatan akan bermuatan parsial positif.
Baca :
- Pengertian Ikatan Ion dan Ikatan Kovalen Serta Contohnya
- Teori Lewis, Struktur Lewis, Contoh Soal, dan Pembahasannya
Dengan demikian, senyawa kovalen polar merupakan senyawa yang minimal tersusun dari dua atom yang bebeda, seperti asam klorida.
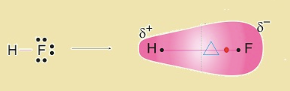
HF terdiri dari dua atom yang berbeda , yaitu atom H dan atom F, yang masing-masing memiliki keelktronegatifan yang berbeda.
Pada molekul HF, pasangan elektron ikatan (PEI) cenderung tertarik ke salah satu atom yang memiliki elektronegativitas lebih besar yaitu atom F.
Oleh karena itu, bentuk molekulnya mengutub pada atom F parsial negatif, sehingga menjadi asimetris (tidak simetris) dan atom H parsial positif. Muatan yang berbeda ini dinamakan δ+ (bermuatan positif) dan δ– (bermuatan negatif).
Ciri-ciri Senyawa Polar
Senyawa kovalen bersifat polar apabila senyawa tersebut memiliki ciri-ciri sebagai berikut .
a. Berbentuk tidak simetris
Senyawa kovalen tidak memiliki bidang simetris, seperti H2O dan NH3
b. Mempunyai momen dipol
Momen dipol akan timbul apabila senyawa kovalen tersebut tersusun dari dua atom dengan keelektronegatifan yang berbeda, seperti HCl dan HBr
2. Senyawa Nonpolar
Ikatan kovalen nonpolar merupakan ikatan yang pasangan elektron ikatannya tertarik sama kuat kearah atom-atom berikatan, seperti Cl2, O2, H2, N2. Berikut ini adalah gambaran senyawa nonpolar pada F2.
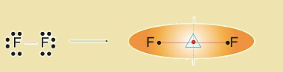
Hal ini terjadi karena antara dua atom F dan F memiliki keelektronegatifan yang sama besar atau perbedaan elektronegativitas adalah nol. Karena PEI tertarik sama kuat, maka bentuk molekul pada senyawa F2 adalah simetris.
Senyawa-senyawa kovalen dengan ikatan kimia dengan kovalen nonpolar, maka tidak ada muatan parsial baik positif maupum negatif dalam molekul-molekul tersebut.
Secara umum kovalen nonpolar mempunyai ciri-ciri sebagai berikut.
a. Berbentuk simetris
Senyawa nonpolar mempunyai bidang simetri pada ikatannya, seperti CH4 . Meskipun C dan H penysusun mempunyai kelektronegatifan yang berbeda, akan tetapi karena molekul berbentuk simetris, maka senyawa tersebut merupakan senyawa kovalen nonpolar.
b. Tidak memiliki momem dipol
Polar tidak nya suatu molekul poliatom dapat mengetahuinya dengan cara menggambarkan kepolaran sebagai vektro yang arahnya dari kutub positif ke kutub negatif.
3. Perbedaan Senyawa Polar dan Nonpolar
Jika resultan vektor dalam satu molekul sama dengan nol, berarti molekul tersebut bersifat nonpolar. Sebaliknya jika resultan vektor tersebut tidak sama dengan nol, berarti molekul tersebut bersifat nonpolar.
Perhatikan beberap contoh senyawa dengan vektor berikut.
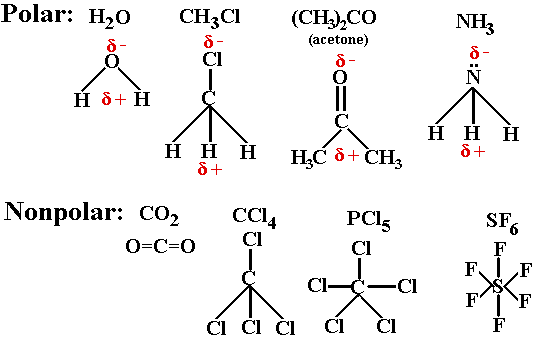
Semakin besar perbedaan keelektronegatifan, maka semakin besar momen dipolnya, sehingga semakin besar sifat kepolaran senyawa tersebut. Sedangkan untuk senyawa nonpolar mepunyai momen dipol sama dengan nol.
Berikut ini adalah momen dipol dari beberapa senyawa.
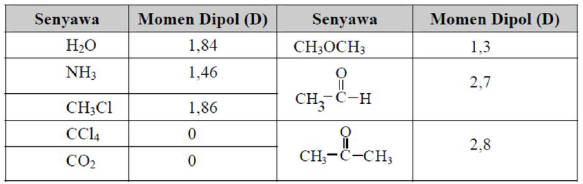
Molekul polar tertarik kedalam medan magnet atau medan listrik. Siifat ini berguna untuk menunjukan kepolaran suatu senyawa.
Perhatikan percobaan kepolaran berikut. Tetesan zat polar dalam biuret akan berbelok arah tertarik batang magnet. Sedangkan tetesan senyawa nonpolar tidak dapat dibelokan oleh batang magnet.
Berdasarkan uraian di atas, maka berikut ini adalah rangkuman perbedaan senyawa polar dan non polar
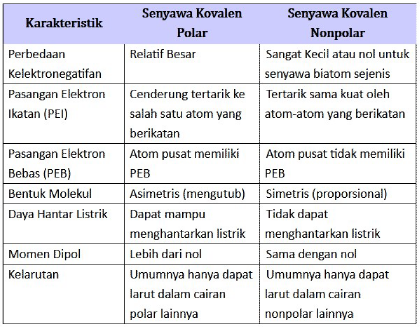
Demikian pengertian senyawa kovalen polar dan nonpolar, serta perbedaannya. Semoga bermanfaat



