Teori Lewis, Struktur Lewis, Contoh Soal, dan Pembahasannya
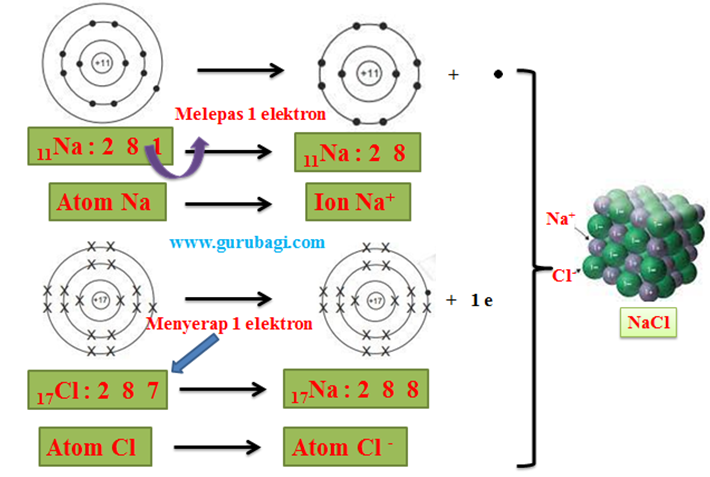
Gurubagi.com. Struktur Lewis merupakan bagian dari ikatan kimia. Ikatan kima dapat terjadi melalui dua proses, yaitu serah terima elektron dan pemakaian bersama pasangan elektron dari suatu atom .
Pada saat atom-atom yang membentuk ikatan kimia, bagian yang berperan dalam serah terima elektron, yaitu hanya elektron pada kulit terluar atau elektron valensi.
Unsur-unsur pada umumnya tidak stabil. Untuk mencapai kestabilan, maka unsur-unsur tersebut harus berikatan dengan unsur lainnya.
Kestabilan unsur
1. Gas mulia
Golongan gas mulia pada sistem periodik terdiri dari unsur–unsur yang stabil dan tidak reaktif. Gas mulia memiliki elektron pada kulit terluar dua (duplet) untuk He, dan delapan (duplet) untuk unsur lainnya, seperti dalam tabel berikut.
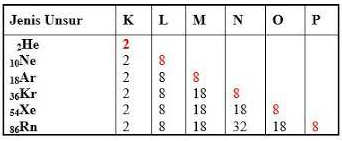
Unsur-unsur golongan gas mulia di atas jarang ditemukan dengan unsur lain, kecuali untuk Kr, Xe dan Rn yang dapat bereaksi meskipun diperlukan kondisi yang khusus.
Baca : Sistem Periodik Modern dan Sifat-sifat Periodik Unsur
2. Struktur Lewis
Untuk mencapai kestabilan, suatu unsur dapat melepas dan menerima elektron pada kulit terluarnya melalui pembentukan ikatan kimia. dengan menggambarkan struktur lewisnya.
Atom yang berikatan akan menggunakan elektron vasensinya masing-masing, sehingga berikatan menjadi susunan yang sempurna atau stabil dan memenuhi kaidah oktet.
Struktur Lewis merupakan suatu pola, titik,silang, atau bulatan yang mengelilingi atom menggambarkan jumlah elektron valensi dari atom-atom yang akan membentuk ikatan kimia.
Struktur Lewis berguna untuk menggambarkan jenis ikatan yang terjadi dalam suatu senyawa dan dapat menggambarkan rumus molekul atau senyawa. Berikut ini struktur Lewis beberapa atom sesuai golongannya
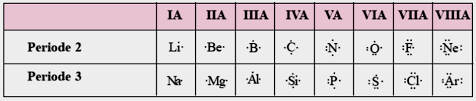
3. Teori Duplet dan Oktet
a. Aturan Duplet
Aturan duplet merupakan konfigurasi stabil suatu unsur dengan jumlah elektron pada kulit terluar (elektron valensi = 2) .
Berikut ini contoh senyawa yang memenuhi kaidah duplet adalah H2 yang terbentuk dari 2 atom H dengan elekron valensi = 1.
Untuk mencapai kestabilan aturan duplet, maka atom H memerlukan 1 elekron lagi dari atom H yang lain, sehingga struktur lewis H2 dapat digambarkan sebagai berikut:
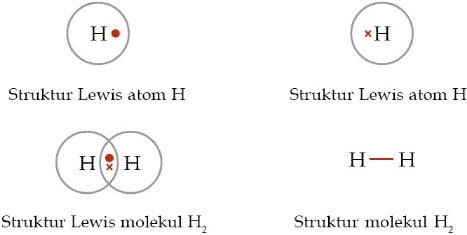
b. Aturan Oktet
Oktet adalah konfigurasi stabil suatu unsur dengan jumlah elektron pada kulit terluar (elektron valnsi = 8).
Contoh senyawa yang memenuhi aturan oktet, yaitu PCl3. Elektron valensi P adalah 5, akan membentuk iktan kimia dengan Cl sebanyak 3 buah.
Cl memiliki elektron valensi 7, sehingga hanya memerlukan 1 elektron dari P untuk mecapai kestabilan (oktet).
Oleh karena itu, masing-masing Cl akan mendapatkan 1 elektron dari P, sedangkan 2 elektron P akan menjadi elektron yang tidak digunakan (elektron bebas).
Senyawa PCl3 membentuk ikatan kovalen yang memenuhi kaidah oktet, dapat terlihat dari masing-masing unsur yang dilingkari memiliki jumlah elektron 8.
Berikut ini adalah gambaran struktur lewis senyawa PCl3.

Pengecualian Aturan Oktet
Pada kenyataannya, tidak semua senyawa yang berikatan selalu memenuhi aturan oktet maupun aturan duplet,
Aturan oktet memiliki beberapa pengecualian dalam merumuskan senyawa. Pengecualian kaidah oktet dibagi dalam tiga kelompok sebagai berikut:
a. Senyawa yang atom pusatnya mempunyai elektron valensi kurang dari 4, sehingga tidak mencapai teori oktet, seperti BeCl2, BCl3, BF3 dan AlBr3.

b. Senyawa dengan jumlah elektron valensi ganjil, seperti ( jumlah elektron NO2 valensi = 5=6=6 = 17).
Berikut ini contoh struktur lewis dari NO2, dapat terlihat bahwa jumlah elektron pada atom pusat kurang dari 8, yaitu hanya 7.

c. Senyawa yang melampaui teori oktet atau menampung lektron lebih dari 8 , seperti PCl5,SFl6, dan SbCl5

Soal dan Pembahasan
Soal nomor 1
Bagaimana kecenderungan atom-atom berikut ini dalam mencapai kestabilannya?
a. 9F
b. 20Ca
c. 16S
d. 13Al
Soal nomor 21
Tuliskan struktur Lewis untuk senyawa berikut ini sesuai kaidah oktet!
a. CH4 (elektron valesi C =4, H =1)
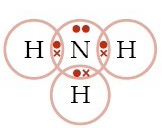
b. NH3 (elektron valensi N =5, H = 1)
c. O2 (elektron valensi O = 6)
d. SO2 (elektron valesi S= 6, O = 6)
Pembahasan:
Soal nomor 1
a. struktur lewis CH4
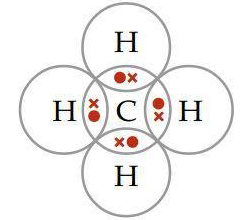
b. NH3
c. O2

1
d. SO2

Soal nomor 2
Untuk mengetahui unsur alam mencapai kestabilan dapat cara menggunkan konfigurasi elektron terlebih dahulu
a. 9F = 2 7
Di dalam mencapai elektron valensi F = 7, maka kestabilanakan dicapai dengan cara menagkap elektron dari luar sebanyak 1, sehingga akan membentuk ion negatif 1.
F → F–
b. 20Ca = 2 8 8 2
Elekron valensi Ca =2, sehingga untuk mencapai kestabilan Ca akan melepaskan 2 elektron terakhirnya sehingga membentuk ion positif 2.
Ca → Ca+2
c. 16S = 2 8 6
Elektron valensi S = 6, untuk mencapai 8, harus menangkap 2 elektron dari luar, sehingga membentuk ion negatif 2.
S → S-2
d. 13Al = 2 8 3
Elektron valensi Al = 3, agar mencapai oktet maka elektron Al harus dilepas 3, sehingga membetuk ion positif 3.
Al →Al+3
Deimkian ulasan mengenai teori Lewis, struktur Lewis, contoh soal, dan pembahasannya. Semoga bermanfaat.