Bunyi Hukum Faraday, Rumus, Contoh Soal dan Pembahasannya
Gurubagi.com. Hukum Faraday merupakan hukum dalam ilmu kimia yang ditemukan oleh imuwan Michael Faraday dari Inggris.
Hukum-hukum Faraday ini menjelaskan tentang hubungan antara massa zat yang dihasilkan di elektrode dengan muatan listrik yang digunakan.
Hukum Faraday menyatakan bahwa besarnya muatan listrik yang terjadi dalam sel merupakan hasil kali antara kuat arus yang dialirkan dengan lamanya waktu elektrolisisnya.
Berikut ini merupakan pernyataan ini dari prinsip dasar Hukum Faraday.
1. Di dalam sel elektrokimia, massa zat yang diendapkan pada suatu electrode sebanding dengan besarnya muatan listrik (aliran elektron yang terlibat di dalam sel)
2. Massa ekuivalen zat yang diendapkan pada eleckrode akan setara dengan muatan listrik yang dialirkan ke dalam sel.
Bunyi Hukum Faraday

Hukum Faraday terbagi menjadi dua jenis, yaitu Hukum Faraday I dan Hukum Faraday II.
Hukum Faraday I
Hukum Faraday I berbunyi: “massa zat yang dihasilkan (w) pada suatu elektrode selama proses elektrolisis berbanding lurus dengan muatan listrik (Q) yang digunakan.”
Secara sistematis, Hukum Faraday I dapat disimpulkan dengan persamaan berikut:
w ≈ Q
Keterangan :
w = massa zat (kg)
Q = muatan listrik dalam elektron (C)
Baca : Sifat Koligatif Larutan Elektrolit, Soal, dan Pembahasannya
Jumlah muatan listrik yang dipakai (Q) sama dengan hasil kali antara kuat arus listrik (i) dan selang waktu (t).
Secara sistematis: dirumuskan sebagai berikut.
Q = i x t
Keterangan :
i = arus listrik (Ampere)
t = waktu (Ssekon)
Dengan demikian, persamaan diatas dapat dirumuskan sebagai berikut:
![]()
Hukum Faraday II
Hukum Faraday II berbunyi: “massa zat yang dihasilkan pada suatu elektrode selama elektrolisis berbanding lurus dengan massa ekivalen zat tersebut.”
Secara sistematis, Hukum Faraday II dapat disimpulkan dengan persamaan berikut:
![]()
Keterangan:
w=massa zat (kg)
ME=massa ekivalen zat (kg)
Massa ekivalen zat adalah massa atom relatif (Ar) dibagi dengan perubahan bilangan oksidasinya atau muatan ionnya. Secara sistematis:
ME = Ar/biloks atau muatan ion
Perbandingan ini menjadi persamaan dengan penambahan faktor 1/96.500, sehingga diperoleh rumus Hukum Faraday
![]()
Keterangan :
w = massa zat yang dihasilkan (kg)
I = Arus listrik (ampere)
t= Waktu (sekon)
ME = Massa ekivalen zat (kg)
Sebelum membahas soal-soal sebaiknya perlu dingat reaksi yg terjadi pada elektrolisi, sebagai berikut.
1. Reaksi pada anoda
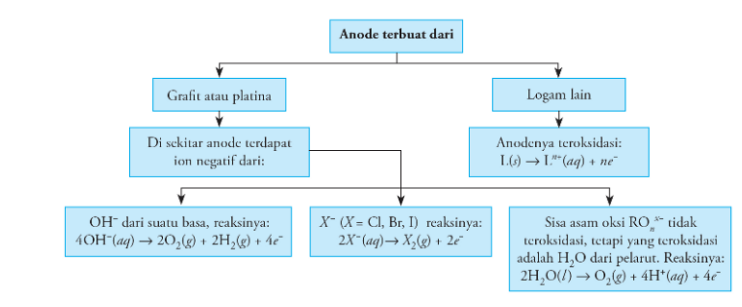
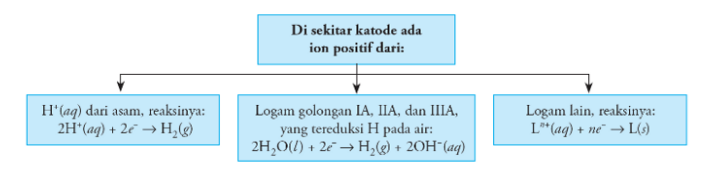
2. Reaksi pada katoda
Contoh Soal Hukum Faraday dan Pembahasan
Soal nomor 1
Fluorin dapat diperoleh dari elektrolisis leburan KHF2, sesuai dengan reaksi berikut :
HF2– ⟶ HF + ½ F2 + e.
Hitunglah waktu yang diperlukan untuk memperoleh 26,88 liter F2 (pada 0oC, 1 atm) dengan arus 10 ampere! (Ar F = 19)
Pembahasan :
Karena gas F2 yang dihasilkan diukur pada keadaan STP maka Jumlah mol F2 = 26,88 L : 22,4 L/mol = 1,2 mol
Jumlah mol elektron = 2 × mol F2 Jumlah mol elektron = 2 × 1,2 mol = 2,4 mol
Jumlah mol elektron = (i × t) : 96500
2,4 mol = (10 ampere × t) : 96500
t = (2,4 × 96.500) : 10
t = 23.160 detik = 386 menit
Soal nomor 2
Larutan K2SO4 dielektrolisis selama 1 jam dengan arus 2 A pada suhu 0oC dan tekanan 1 atm. Tulislah reaksi yang terjadi pada anode dan katode serta hitunglah volume gas yang terjadi di katode dan anode!
Pembahasan :
Perhatikan reaksi sebagai berikut :
K2SO4(aq) → 2K+(aq) + SO42-(aq)
Perhatikan reaksi yang terjadi pada anoda dan katonya berikut ini :
Anode : 2H2O → O2 + 4H+ + 4e
Katode : 2H2O + 2e →H2 + 2OH–
Di katode yang direduksi adalah H2O karena ion golongan IA tidak mengalami reaksi reduksi. Pada anode yang dioksidasi adalah H2O karena SO42- merupakan sisa asam oksi sehingga tidak mengalami oksidasi pada katoda.
1 jam = 3.600 detik
jumlah mol elektron = ![]()
= ![]()
Pada anoda jumlah mol O2
= 1/4 x 0,075 = 0,01875 mol pada kondisi suhu 0oC, danP = 1 atm
Volume O2
= 0,01875 x 22,4L/mol
Volume O2 = 0,42 L
Pada katode jumlah H2
= 1/2 x 0,075
= 0,0375 mol
Volume H2
= 0,0375 x 22,4
= 0,84 L
Soal nomor 3
Fluorin dapat diperoleh dari elektrolisis leburan KHF2, sesuai persamaan reaksi berikut.
HF2– ⟶ HF + ½ F2 + e.
Hitunglah muatan listrik yang diperlukan untuk menghasilkan gas fluorin sebanyak 2,24 liter (STP)! (1F = 96500C)
Pembahasan :
Karena gas F2 yang dihasilkan diukur pada keadaan STP, maka jumlah mol F2 = 2,24 L : 22,4 L = 0,1 mol
Jumlah mol elektron = 2 × mol F2
Jumlah mol elektron = 2 × 0,1 mol = 0,2 mol
Muatan listrik = 0,2 mol × 96500 C/mol = 19.300 C
Soal nomor 4
Pada elektrolisis larutan NiSO4 selama 45 menit menghasilkan endapan Ni sebanyak 9,75 gram. Berapa gram Ag yang dihasilkan jika arus dalam waktu yang sama dialirkan pada elektrolisis larutan AgNO3? (Ar Ni = 58,5; Ag = 108)
Pembahasan :
Diketahui:
m Ni = 9,75 g
e Ni = 58,5/2 = 29,25
e Ag = 108/1 = 108
Ditanya: m Ag….?
Jawab:
m Ni : m Ag = e Ni : e Ag
9,75 : m Ag = 29,25 : 108
m Ag = 9,75 x 108 : 29,25 = 36 gr
Jadi Ag yang dihasilkan jika arus dalam waktu yang sama dialirkan pada elektrolisis larutan AgNO3 sebesar 36 gr.
Demikian ulasan mengenai bunyi Hukum Faraday, rumus, contoh soal, dan pembahasannya. Semoga bermanfaat.

