Contoh Soal Kimia Laju Reaksi Kelas 11 SMA MA dan Kunci Jawabannya
Gurubagi.com. Berikut ini kami bagikan contoh soal Kimia materi Laju Reaksi kelas 11 SMA MA dan kunci jawabannya.
Latihan soal Kimia Laju Reaksi kelas 11 SMA MA dan kunci jawabannya ini untuk membantu belajar peserta didik dalam memahami materi Kimia tentang Laju Reaksi.
Pengertian laju reaksi adalah adalah besarnya perubahan jumlah pereaksi dan hasil reaksi per satuan waktu. Laju reaksi dinyatakan dengan satuan konsentrasi molar (molaritas).
Oleh karena itu, laju reaksi dapat dikatakan perubahan konsentrasi akhir (hasil reaksi) terhadap konsentrasi awal (pereaksi) per satuan waktu.
Baca : Pengertian Laju Reaksi, Rumus, dan Faktor-faktor yang Memengaruhinya
Contoh soal Kimia materi Laju Reaksi ini berbentuk Pilihan Ganda dengan lima alternatif jawaban dan sudah tersedia kunci jawabannya yang dapat di unduh dengan mudah.

Soal nomor 1
Laju reaksi A + B –> AB dapat dinyatakan sebagai penambahan konsentrasi ….
a. A tiap satuan waktu
b. B tiap satuan waktu
c. AB tiap satuan waktu
d. A dan B tiap satuan waktu
e. A, B, dan AB tiap satuan waktu
Soal nomor 2
Perhatikan persamaan berikut!
BrO3– + 5Br– + 6H+ → 3Br2 + 3H2O
Berdasarkan eksperimen, dirumuskan bahwa kecepatan reaksinya = k[BrO3–] [Br] [H+]2, sehingga dapat dinyatakan bahwa ….
a. reaksi tersebut memiliki orde 3
b. tingkat reaksi itu adalah lima tahapan ion bromida
c. orde reaksi totalnya adalah 12
d. perubahan [H+] tidak mengubah kecepetan reaksi
e. tingkat reaksi itu adalah satu tahapan ion bromat
Soal nomor 3
Perhatikan tabel percobaan reaksi berikut!
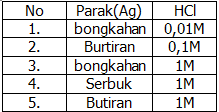
Sesuai data tersebut, percobaan yang paling cepat bereaksi adalah nomor ….
a. 1
b. 2
c. 3
d. 4
e. 5
Soal nomor 4
Perhatikan data percobaan reaksi berikut!
Mg + 2HCl → MgCl2 + H2
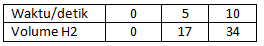
Jika reaksi berlangsung pada suhu 25oC, maka laju reaksi pembentukan gas H2 rata-rata 10 detik pertama adalah …
a. 2,2 ml/detik
b. 2,5 ml/detik
c. 2,8 ml/detik
d. 3,4 ml/detik
e. 4,8 ml/detik
Soal nomor 5
Kenaikan suhu akan mempercepat laju reaksi, karena .…
a. energi kinetik partikel-partikel yang bereaksi semakin tinggi
b. kenaikan suhu akan menyebabkan konsentrasi pereaksi meningkat
c. frekuensi tumbukan semakin tinggi
d. dalam reaksi kimia suhu berperan sebagai katalisator
e. kenaikan suhu akan mengakibatkan turunnya energi aktivasi
Soal nomor 6
Di dalam wadah tertutup, penguraian sulfuril klorida (SO2Cl2) menurut reaksi SOCl2 → SO2 + Cl2 mempunyai laju v = k[SO2Cl2].
Pernyataan yang benar untuk reaksi tersebut adalah …
a. Laju reaksi (v) akan semakin cepat selama reaksi berlangsung.
b. Laju reaksi (v) menjadi lebih cepat jika volume wadah diperbesar.
c. Konsentrasi SO2 akan bertambah dengan laju sebesar v.
d. Konsentrasi SO2Cl2 akan bertambah dengan laju sebesar v.
e. Satuan konsentrasi laju reaksi (k) adalah M-1S-1.
Soal nomor 7
Berikut diberikan data percobaan laju reaksi Q + 2T → T2Q pada beberapa kondisi.
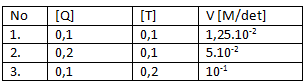
Jika [Q] dan [T] masing-masing diubah menjadi 0,5 M, maka harga laju (v) reaksi saat itu adalah …..
a. 5,0 M/detik
b. 7,5 M/detik
c. 10,5 M/detik
d. 12,5 M/detik
e. 39,0 M/detik
Soal nomor 8
Laju reaksi (v) antara A dan B mengikuti persamaan laju v = k [A]2 [B]2
Jika k adalah konsentrasi A pada suatu percobaan dijadikan setengah kali semula, maka konsentrasi B harus ….
a. dinaikan 4 kali semula
b. dinaikan ¼ kali semula
c. dinaikan 2 kli semula
d. diturunkan ½ kali semula
e. dibuat tetap atau konstan
Soal nomor 9
Pada percobaan reaksi gas nitrogen dan hidrogen dengan persamaan reaksi N2 + 3H2 → 2NH3 didapatkan hasil percobaan sebagai berikut.
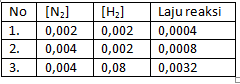
Persamaan laju reaksi dari data di atas adalah ….
a. v = k[N2][H2]
b. v = k[N2] [H2]2
c. v = k[N2]2 [H2]3
d. v = k[N2]
e. v = k[H2]2
Soal nomor 10
Berikut adalah data percobaan laju reaksi dari reaksi K + L –> M
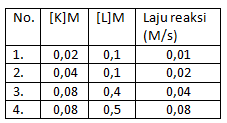
Rumus laju reaksinya adalah ….
a. v = k[K]2 [L]
b. v = k[K]2 [L]2
c. v = k[K] [L]2
d. v = k[K] [L]
e. v = k[K]
Soal nomor 11
Perhatikan data percobaan dari reaksi berikut!
2SO2 + O2 → 2SO3
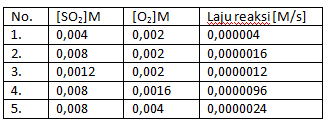
Orde reaksi totalnya adalah ….
a. 1
b. 2
c. 3
d. 4
e. 5
Soal nomor 12
Sekeping logam seng direaksikan dengan larutan asam sulfat 2M dan bereaksi menurut reaksi
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)
Data yang diperoleh dari reaksi di atas, setelah beberapa menit adalah sebagai berikut.
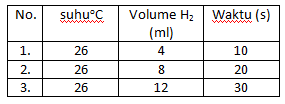
Laju reaksi pembentukan gas hidrogen (H2) adalah sebesar ….
a. 0,1 ml/detik
b. 0,2 ml/detik
c. 0,3 ml/detik
d. 0,4 ml/detik
e. 0,5 ml/detik
Soal nomor 13
Pada percobaan reaksi antara logam aluminium dan asam sulfat sesuai persamaan reaksi : 2Al(s) + H2SO4(aq) → Al2(SO4)2(aq) + 3H2(g), gas hidrogen ditampung dan diukur volumenya pada temperatur tetap.
Data pengukuran tiap waktu sesuai tabel berikut
| No | Waktu Reaksi (Detik) | Volume Gas (mL) |
| 1 | 0 | 0 |
| 2 | 15 | 40 |
| 3 | 30 | 80 |
Laju reaksi pembentukan gas hidrogen setelah 30 detik adalah sebesar ….
a. 0,83 ml/detik
b. 1,33 ml/detik
c. 2,67 ml/detik
d. 2,50 ml /detik
e. 7.50 ml/detik
Soal nomor 14
Berikut adalah data hasil percobaan laju reaksi dari :
2NO(g) + 2H2(aq) → N2(g) + H2O(g)
| No. Percobaan | Konsentrasi (M) | Laju Reaksi (M/s) | |
| NO | H2 | ||
| 1 | 4 x 10-3 | 1,5 x 10-3 | 32 x 10-3 |
| 2 | 4 x 10-3 | 3 x 10-3 | 64 x 10-3 |
| 3 | 6 x 10-3 | 6 x 10-3 | 128 x 10-3 |
| 4 | 3 x 10-3 | 8 x 10-3 | 32 x 10-3 |
Berdasarkan data tersebut, maka orde reaksi totalnya adalah ….
a. 1
b. 2
c. 3
d. 4
e. 5
Soal nomor 15
Pernyataan di bawah ini benar mengenai faktor-faktor yang memengaruhi laju reaksi, kecuali ….
a. penambahan katalis memperlambat laju reaksi
b. semakin tinggi tekanannya, semakin kecil volumenya
c. semakin tinggi suhu, reaksi berlangsung semakin cepat
d. semakin luas permukaan bidang sentuh, reaksi semakin cepat
e. semakin besar konsentrasi, reaksi semakin cepat
Kunci jawaban dari soal materi kimia laju reaksi di atas dapat di unduh di sini.
Demikian yang dapat kami bagikan mengenai contoh soal Kimia materi Laju Reaksi kelas 11 SMA MA dan kunci jawabannya. Semoga bermanfaat.