Konfigurasi Elektron, Diagram Orbital, Contoh Soal, dan Pembahasannya
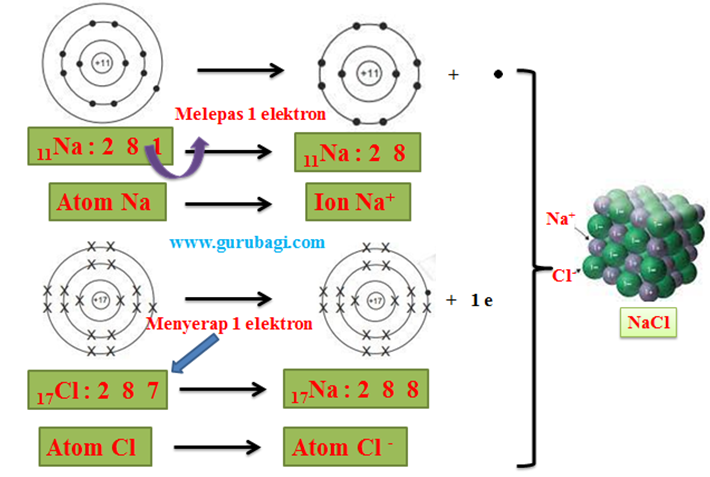
Gurubagi.com. Atom terdiri atas inti dan elektron yang beredar mengitarinya menurut lintasannya masing-masing.
Untuk mengetahui bagaimana lintasan elektron tersebut, maka dapat kita melihat penyebaran elektron dalam kulit-kulit elektron melalui konfigurasi elektron.
Konfigurasi elektron merupakan persebaran elektron pada kulit-kulit atom. Penentuan konfigurasi elektron dapat dilakukan dengan menggunakan dua cara, sebagai berikut.
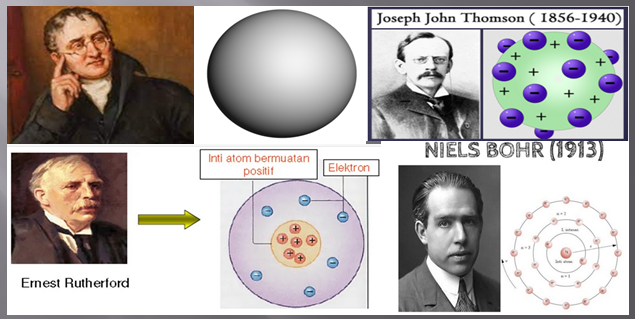
1. Konfiguarasi Elektron Berdasarkan Kulit Atom (Teori Bohrn)
Jumlah elektron maksimum yang bisa ditampung oleh kulit atom adalah 2n², dimana n adalah kulit ke-n. Kulit ke-1 dinamakan kulit K, kulit ke-2 dinamakan kulit L, dan seterusnya sesuai dengan urutan angka dan abjad.
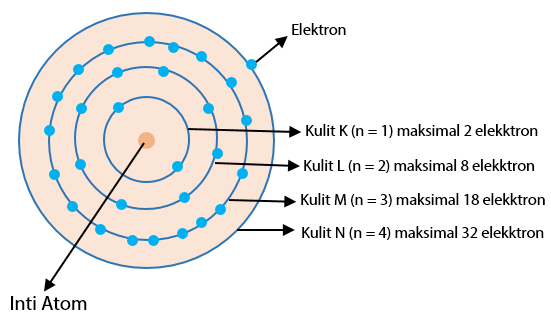
Berikut ini adalah contoh cara penulisan konfigurasi elektron berdasarkan kulit atom.
Tentukan konfigurasi elektron dari unsur K dengan nomor atom 17!
Pembahasan:
Isikan elektron ke dalam kulit atom sesuai daya tampung maksimumnya.
- K = 2
- L = 8
- M = 7
Jika elektron yang tersisa kurang dari daya tampung maksimum kulit atomnya, gunakan aturan di bawah ini.
- Jika elektron tersisa kurang dari 8, maka seluruh sisa elektron isikan pada kulit selanjutnya.
- Apabila elektron tersisa lebih dari atau sama dengan 8, tetapi kurang dari 18, maka 8 elektron isikan pada kulit atom, sedangkan sisanya mengikuti aturan pertama.
- JIka elekrron tersisa lebih dari atau sama dengan 18 tetapi kurang dari 32, maka 18 elektron isikan, sedangkan sisanya mengikuti aturan sebelumnya.
- Jika elektron tersisa lebih dari atau sama dengan 32, maka isikan 32 elektron, dan sisa elektron mengikuti aturan sebelumnya.
Baca : Struktur Atom, Perkembangan Teori Atom, dan Partikel Penyusunnya
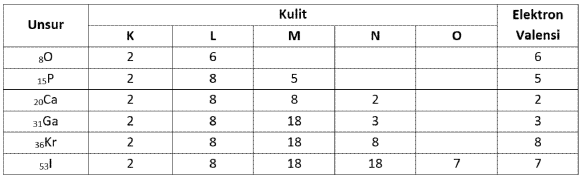
Contoh pengisisan elektron masing-masing unsur gas mulia pada kulit-kulitnya.
2. Konfigurasi Elektron Berdasarkan Orbital (Teori atom Modern)
Pengisian elektron berdasarkan orbital (teori atom modern) mengikuti beberapa aturan berikut.
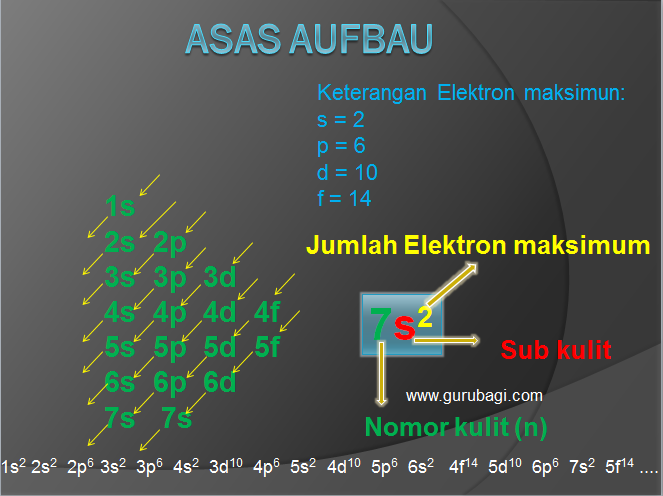
a. Asas Aufbau
Berdasarkan Asas Aufbau, pengisian orbital isi dasar bahwa elektron akan menempati kulit elektron dari subkulit yanbg tingkat energinya rendah ke tingkat yang energinya tinggi.
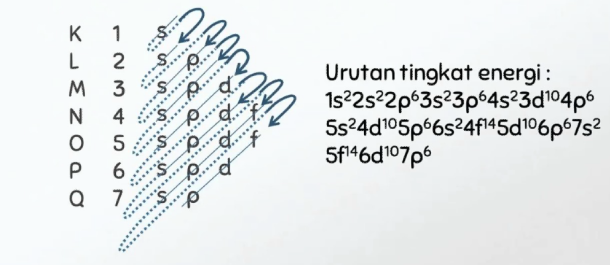
Pengisian elektron berdasarkan asas Aufbau
Keterangan:
Maing-masing orbital memiliki elektron maksimum.
- s, elektron maksimal = 2
- p, elektron maksimal = 6
- d, elektron maksimal = 10
- f, elektron maksimal =14
Contoh:
Tuliskan konfigurasi elektron untuk magnesium dengan nomor atom 12, dan vanadium dengan nomor atom 23!
Pambahasan:

b. Larangan Pauli
Wolfgang Pauli menyatakan bahwa, dalam suatu atom tidak boleh terdapat dua elektron yang memiliki keempat bilangan kuantum (n, l, m, dan s) yang sama.
Akan tetapi, jika terdapat dua elektron menempati orbital yang sama, maka bilangan kuantum spin dua elektron ini harus berbeda.
c. Kaidah Hund
Berdasarkan aturan Hund, pengisisan orbital-orbital dari satu sub kulit mula-mula elektron akan menempati orbital sendiri-sendiri dengan spin paralel, baru setelah itu jika elektron masih ada makan akan berpasangan.
Contoh:
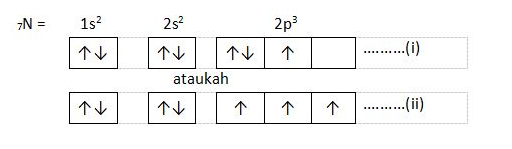
Berdasarkan pembahasan di atas yang memenuhi aturan Hund adalah penulisan pada nomor (ii), karena elektron harus mengisi seluruh orbital terlebih dahulu sebelum berpasangan.
Untuk menuliskan konfigurasi elektron dapat dilakukan dengan beberapa cara berikut ini.
a. Penulisan urutan sub kulit
Contoh Penulisan konfigurasi
36Kr = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 = sesuai urutan tingkat energinya
36Kr = 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 = sesuai kenaikan bilangan kuantum
b. Penulisan dengan konfigurasi elektron gas mulia
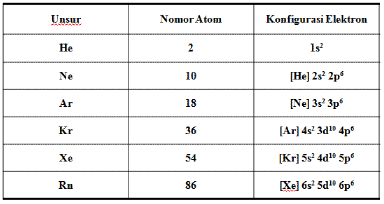
Pengisisan elektron dari unsur gas mulia dapat digunakan untuk menyingkat penulisan konfigurasi elektron unsur yang lain. Seperti, penulisan elektron unsur 21Sc.
21Sc = 1s2 2s2 2p6 3s2 3p6 3d1 4s2
Jika disingkat maka menjadi :
21Sc = [Ar] 3d1 4s2
c. Kestabilan subkulit d yang terisi atau setengah penuh
Misalkan untuk unsur Cu berikut.
₂₉Cu = 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁹
Sesuai pengisisan elektron unsur Cu terlihat bahwa hanya orbital 4s yang penuh dan stabil. Sedangkan orbital 3d tidak penuh atau setengah penuh, sehingga bersifat tidak stabil. Oleh karena itu, konfigurasi elektron Cu menjadi :
₂₉Cu = 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ 3d¹⁰
4s¹ 3d¹⁰lebih stabil (4s¹ 3d¹⁰ setengah penuh – penuh) dari pada konfigurasi elektron Cu, sehingga pengisisn elektron Cu yang benar adalah sebagai berikut.
₂₉Cu = 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁹
Baca :
- Latihan Soal Kimia Konfigurasi Elektron Kelas 10 SMA MA Kurikulum 2013
- Contoh Soal Konfigurasi Elektron Kimia Kelas 10 SMA MA Kurikulum 2013
- Konfigurasi Elektron, Diagram Orbital, Contoh Soal, dan Pembahasannya
Demikian ulasan mengenai konfigurasi elektron dan diagram orbital. Semoga bermanfaat.