Laju Reaksi : Pengertian, Contoh Soal, dan Faktor yang Mempengaruhinya
Gurubagi.com. Reaksi kimia dapat dapat berlangsung secara cepat maupun lambat. Setiap reaksi kimia berlangsung dengan laju kecepatan dan kondisi tertentu. Konsep ini disebut dengan laju reaksi.
Secara matematis, laju reaksi adalah perubahan konsentrasi tiap perubahan waktu dengan kata lain laju reaksi adalah kecepatan suatu reaktan bereaksi hingga habis. Laju reaksi juga berarti seberapa cepat reaksi kimia membentuk zat baru.
Di dalam laju reaksi, umumnya penyebutan satuan dinyatakan dengan M/s (molaritas per detik) atau yang disebut juga dengan molaritas. Molaritas itu sendiri ialah ukuran yang menyatakan banyak mol zat terlarut dalam satu liter larutannya.
Laju reaksi dapat berjalan lambat atau ceapat. Misalnya ketika menyalakan kompor, ada reaksi yang terjadi karena pertemuan gas dan percikan api dari pemantik. Reaksi itu berlangsung cepat.
Akan tetapi, ada juga reaksi yang membutuhkan waktu lama bahkan ribuan tahun seperti terbentuknya minyak dari fosil atau perkararan besi.
Baca : Contoh Soal Kimia Laju Reaksi Kelas 11 SMA MA dan Kunci Jawabannya
Persamaan laju reaksi
Persamaan laju reaksi merupakan sebuah persamaan yang memperlihatkan keterkaitan atau hubungan antara laju reaksi tertentu dengan konsentrasi pereaksinya. Berikut ini persamaan untuk laju reaksi.
aA(g) + bB(g) → cC(g) + dD(g)
(Reaktan) (Produk)
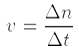
Di mana, v= laju reaksi (mol/L/s); = perubahan mol; = perubahan waktu
atau,
v = k [A]n[B]m
Di mana, v= Laju reaksi (mol/L/s) ; k= konstanta laju reaksi; n= orde reaksi zat B; m= orde reaksi zat A.
Secara logika, pada saat bereaksi, zat reaktan pasti makin berkurang, dan zat produk pasti bertambah., sehingga dapat diartikan secara sederhana, bahwa:
- Reaktan, Laju reaksi adalah berkurangnya konsentrasi zat tiap satuan waktu.
- Produk, laju reaksi adalah bertambahnya konsentrasi zat tiap satuan waktu.
Soal Konsep Laju Reaksi
Soal nomor 1
Data percobaan dari reaksi : NH4+ (aq) + NO (aq) → N2 (aq) + 2H2O (l)
Berdasarkan percobaan di atas, tentutkan rumus laju reaksinya ?
Pembahasan
Untuk NO2–, kita bandingkan data 1 terhadap data 2 :
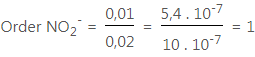
Untuk NH4+, kita bandingkan data 4 terhadap data 5 :
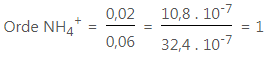
Maka rumus kecepatan reaksinya adalah = r = k[ NO2–][NH4+]
Soal nomor 2
Dalam suatu reaksi kimia, setiap kenaikan suhu 10°C reaksi menjadi dua kali lebih cepat. Beberapa kali lebih cepat reaksi pada 80° C dibandingkan pada suhu 20°C
Pembahasan :
Reaksi menjadi 2x lebih cepat → n = 2 Pada setiap ΔT = 10oC
Maka jika T1 = 20oC
T2 = 80 oC
v pada 80oC = ![]()
v pada 80oC = 26
Maka v pada 80oC adalah 64 x lebih cepat
Faktor yang mempengaruhi laju reaksi
Laju reaksi dipengaruhi oleh 4 faktor yaitu luas permukaan bidang sentuh, konsentrasi, kenaikan suhu, dan katalis. Berikut ini penjelasannya.
1. Luas permukaan bidang sentuh
Kecepatan reaksi dipengaruhi oleh ukuran partikel zat. Semakin luas permukaan bidang sentuh zat yang bereaksi akan mempermudah terjadinya tumbukan efektif. Tumbukan efektif ini akan menyebabkan reaksi kimia yang mempercepat laju reaksi.
2. Konsentrasi
Laju reaksi akan semakin cepat seiring bertambahnya konsentrasi pereaksi, begitu juga sebaliknya.
3. Kenaikan suhu
Kenaikan suhu mempercepat laju reaksi karena kenaikan suhu menyebabkan gerakan partikel semakin cepat.
4. Katalis
Katalis dapat mempengaruhi laju reaksi. Katalis yang dapat mempercepat laju reaksi disebut katalis positif atau dikenal dengan nama katalisator. Sedangkan katalis yang memperlambat laju reaksi disebut katalis negatif atau dikenal dengan nama inhibitor.
Demikian pengertian laju reaksi, contoh soal dan faktor yang mempengaruhinya. Semoga bermanfaat