Latihan Soal Sel Volta Kimia Kelas 12 SMA MA Kurikulum 2013
Gurubagi.com. Berikut ini kami bagikan latihan soal sel volta untuk kimia kelas 12 SMA MA dan kunci jawabannya.
Latihan soal sel volta kimia kelas 12 SMA MA ini untuk membantu belajar peserta didik dalam memahami materi sel volta.
Bentuk latihan soal sel volta kimia kelas 12 SMA/MA ini adalah Pilihan Ganda dengan lima alternatif jawaban dan sudah tersedia kunci jawabannya yang dapat di unduh dengan mudah.
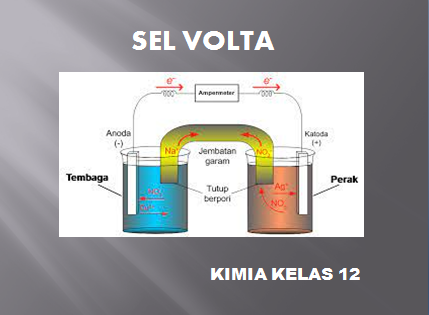
Soal nomor 1
Sel volta terdiri dari elektrode perak dan tembaga, jika :
Ag+ + e → Ag E0 = +0,80 volt
Cu2+ + 2e → Cu E0 = +0,34 volt
Pernyataan di bawah ini yang benar adalah ….
A. Ag sebagai Anoda
B. Cu sebagai Katoda
C. potensial selnya = 0,46
D. elektroda Ag semakin tipis
E. Cu larut dalam air
Soal nomor 2
Diketahui elektroda :
Eo = 0,79 volt
Eo = -2,34 volt
maka notasi sel yang terbentuk adalah ….
A. Ag+ / Ag // Mg2+ / Mg
B. Mg2+ / Mg // Ag / Ag+
C. Ag / Ag+ // Mg / Mg2+
D. Mg / Mg2+ // Ag+ / Ag
E. Ag+ / Ag // Mg /Mg2+
Soal nomor 3
Perhatikan data Eo berikut!
Zn2+ / Zn = – 0,76 volt
F2 / 2F– = +3,63 volt
Fe2+ / Fe = – 0,44 volt
Ag+/Ag = +0,83 volt
Ca2+/ Ca = – 2,8 volt
E sel yang paling kecil terdapat pada reaksi redoks ….
A. Ca + Ag+ → Ca2+ + Ag
B. Ca + F2 → Ca2 ++ 2F –
C. Fe + Ca2+ → Fe2+ + Ca
D. Zn + F2 → Zn2+ + 2F –
E. Zn + Fe2+ → Fe + Zn2+
Soal nomor 4
Perhatikan gambar sel volta berikut!
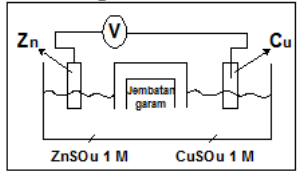
Diketahui :
Eo : Zn2+ /Zn = -0,76 V
Eo: Cu2+ /Cu = +0,34 V
Pernyataan berikut sesuai dengan gambar sel volta di atas, kecuali ….
A. elektron mengalir dari elektroda Zn ke elektroda Cu
B. logam Zn bertindak sebagai anoda
C. potensial sel yang dihasilkan sebesar 1,10 Volt
D. di katoda terjadi reduksi ion Cu2+
E. jembatan garam dapat diganti kawat penghantar
Soal nomor 5
Diketahui data potensial standar berikut.
Zn2+ + 2e → Zn Eo = -076 Volt
Cu2+ + 2e → Cu Eo = +076 Volt
Mg2+ + 2e → Mg Eo = -2,34 Volt
Cr3+ + 3e → Cr Eo = -0,74 Volt
Harga potensial sel yang paling besar terdapat pada ….
A. Zn /Zn2+ // Cu2+ / Cu
B. Cr /Cr3+ // Cu2+ / Cu
C. Zn /Zn2+ // Cr3+ / Cr
D. Mg /Mg2+ // Cu2+ / Cu
E. Mg /Mg2+ // Cr3+ / Cr
Soal nomor 6
Diketahui lima kelompok unsur A, B, C, D dan E. Dari percobaan diperoleh data sebagai berikut : Logam B merupakan reduktor paling kuat.Logam A dan C dapat mereduksi ion D2+ menjadi D, tetapi tidak dapat mereduksi E2+.Logam C dapat mereduksi ion A2+ menjadi A. Urutan harga potensial elektroda standar semakin meningkat adalah ….
A. A – B – C – D – E
B. E – D – C – B – A
C. B – C – A – D – E
D. B – E – C – A – D
E. B – E – D – A – C
Soal nomor 7
Diketahui : Eo Cu : +0,34 : Eo Pb : –0,13 : Eo Mg : –2,37. Reaksi berikut yang berlangsung adalah ….
A. Cu + Mg2+
B. Pb + Cu2+
C. Pb + Mg2+
D. Mg + Cu2+
E. Cu + Pb2+
Soal nomor 8
Jika diketahui :
Zn + Cu2+ ↔ Zn2+ + Cu Eo = +1,10 volt
Mg2+ + 2e ↔ Mg Eo = -2,37 volt
Cu2+ + 1e ↔ Cu Eo = +0,34 volt
maka potensial standar bagi reaksi Zn2+ + Mg ↔ Zn + Mg2+ adalah ….
A. -1,61 volt
B. +1,61 volt
C. -1,27 volt
D. +1,27 volt
E. +2,37 volt
Soal nomor 9
Diketahui potensial elektrode dari :
Al3+ + 3e ↔ Al E° = -1,66 Volt
Zn2+ + 2e ↔ Zn E° = -0,76 Volt
maka reaksi redoks 2Al(s) + 3Zn2+(aq) ↔ 2Al3+(aq) + 3Zn(s) akan menghasilkan potensial sel sebesar ….
A. + 0,90 Volt
B. – 0,90 Volt
C. + 1,04 Volt
D. – 1,04 Volt
E. + 2,42 Volt
Baca : Contoh Soal Sel Elektrolisis dan Hukum Faraday Kimia Kelas 12 SMA MA
Soal nomor 10
Diketahui harga potensial elektrode standar (E°) dari beberapa logam sebagai berikut.
Al3+(aq) / Al(s) E° = -1,66 Volt
Fe2+(aq) / Fe(s) E° = -0,44 Volt
Cu2+(aq) / Cu(s) E° = +0,34 Volt
Ag+(aq) / Ag(s) E° = +0,80 Volt
Berdasarkan data tersebut, reaksi di bawah ini yang berlangsung spontan adalah ….
A. Fe + Ag+ → Fe2+ + Ag
B. Cu + Fe2+ → Cu2+ + Fe
C. Cu + Al3+ → Cu2+ + Al
D. Ag + Al3+ → Ag+ + Al
E. Ag + Cu2+ → Ag+ + Cu
Soal nomor 11
Diketahui data potensial elektrode standar sebagai berikut.
Ag+(aq) + e → Ag(s) E° = +0,80 volt
Cu2+(aq) + 2e → Cu(s) E°=+0,34 volt
Zn2+(aq) + 2e → Zn(s) E° = -0,76 volt
Mg2+(aq) + 2e → Mg(s) E° = -2,37 volt
Reaksi redoks berikut yang dapat berlangsung spontan adalah ….
A. Ag(s) + Cu2+(aq) → Ag+ (aq) + Cu(s)
B. Cu(s) + Zn2+(aq) → Cu2+ (aq) + Zn(s)
C. Zn(s) + Ag+ (aq) → Zn2+ (aq) + Ag(s)
D. Zn(s) + Mg2+ (aq) → Zn2+(aq) + Mg(s)
E. Ag(s) + Mg2+ (aq) → Ag+(aq) + Mg(s)
Soal nomor 12
Diketahui :
F2(g) + 2e → 2F–(aq) E° = +2,87 volt
Cl2(g) + 2e →2Cl–(aq) E° = +1,36 volt
Br2(g) + 2e →2Br–(aq) E° = +1,06 volt
C2(g) + 2e → 2I–(aq) E° = +0,54 volt
Berdasarkan harga E°, reaksi berikut yang tidak berlangsung adalah ….
A. F2 + KCl
B. Cl2 + NaBr
C. Br2 + NaCl
D. Br2 + NaI
E. Cl2 + NaI
Soal nomor 13
Logam P, Q, dan R menunjukkan reaksi-reaksi berikut.
P + Q2+ →P2+ + QQ + R2+ →tidak berlangsung
P + R2+ → P2+ + R
Urutan ketiga logam itu yang sesuai dengan peningkatan harga potensial reduksinya adalah ….
A. P > R > Q
B. P > Q > R
C. P < R < Q
D. R < P < Q
E. P < Q < R
Soal nomor 14
Diketahui :
Ni2+ + 2e → Ni Eo = -0,25 Volt
Pb2+ + 2e → Pb Eo = -0,13 Volt
Potensial standar sel volta yang terdiri dari elektroda Ni dan Pb adalah ….
A. –0,38 V
B. +0,38 V
C. +0,25 V
D. –0,12 V
E. +0,12 V
Soal nomor 15
Diketahui :
Mg2+ + 2e →Mg Eo = -2,34 V
Ni2+ + 2e →Ni Eo = -0,25 V
Cu2+ + 2e →Cu Eo = +0,34 V
Ag+ + 2e → Ag Eo = +0,80 V
Reaksi yang tidak berlangsung adalah ….
A. Mg + Cu2+ → Mg2+ + Cu
B. Ni + Ag+ → Ni2+ + Ag
C. Mg + Ag+ → Mg2+ + Ag
D. Cu + Ag+ → Cu2+ + Ag
E. Cu + Ni2+ → Cu2+ + Ni
Kunci Jawaban – Unduh
Demikian yang dapat kami bagikan mengenai latihan soal sel volta kimia kelas 12 SMA MA Kurikulum 2013. Semoga bermanfaat.