Latihan Soal UKK PAT Kimia Kelas 10 SMA MA SMK Tahun 2021
Gurubagi.com. Berikut ini adalah Latihan Soal UKK PAT Kimia Kelas 10 SMA MA SMK Tahun 2021. Latihan soal kima ini untuk membantu belajar peserta didik kelas 10 SMA Ma dan SMK menghadapi Ulangan Kenaikan Kelas Tahun Pelajaran 2020/2021.
Soal UKK PAT Kimia SMA MA SMK juga untuk memberikan gambaran mengenai bentuk soal UKK/PAT mata pelajaran kimiai pada peserta didik kelas 10 kurikulum 2013 tahun pelajaran 2020/2021.
Latihan soal UKK/PAT kimia ini merupakan bentuk evaluasi belajar peserta didik kelas 10 SMA MA dan SMK. Soal latihan ini berasal dari materi kimia kelas 10 SMA MA SMK semester genap Kurikulum 2013.
Ulangan Kenaikan Kelas (UKK) atau Penilaian Akhir Tahun (PAT) adalah kegiatan ujian sekolah pada akhir semester genap, sehingga berguna untuk mengukur pencapaian kompetensi peserta didik pada akhir semester genap. Cakupan soal UKK/PAT meliputi seluruh indikator yang mempresentasikan KD pada semester tersebut.
Latihan soal UKK PAT Kimia ini diambil dari materi kimia kelas 10 SMA/MA/MAK semester genap Kurikulum 2013, yaitu berikut.
- Larutan Elektrolit dan Larutan Nonelektrolit
Reaksi Oksidasi dan Reduksi serta Tata nama Senyawa
Hukum-hukum dasar Kimia dan Stoikiometri
Rangkuman Materi
1. Larutan Elektrolit dan Larutan Nonelektrolit
Berdasarkan daya hantar listriknya (daya ionisasinya) larutan terbagi dalam dua macam, yaitu larutan elektrolit dan larutan non elektrolit.
a. Elektrolit
Larutan elektrolit adalah zat yang saat dilarutkan dalam air akan mendapatkan larutan yang bisa menghasilkan arus listrik. Jenis larutan ini terbagi menjadi dua, yaitu larutan elektrolit kuat dan larutan elektrolit lemah.
Larutan elektrolit kuat adalah larutan yang mempunyai daya hantar listrik yang kuat, karena zat terlarutnya di dalam pelarut (umumnya air), seluruhnya berubah menjadi ion-ion (α = 1).
Berikut ini adalah contoh larutan yang tergolong elektrolit kuat.
- Asam-asam kuat, seperti HCl, HCl03, H2SO4, dan HNO3.
- Basa-basa kuat, yaitu basa-basa golongan alkali dan alkali tanah, seperti: NaOH, KOH, Ca(OH)2, dan Ba(OH)2.
- Garam-garam yang mudah larut, seperti NaCl, KI, dan Al2(SO4)
Larutan elektrolit lemah adalah larutan yang daya hantar listriknya lemah dengan harga derajat ionisasi sebesar 0< α < 1.
Contoh larutan yang tergolong elektrolit lemah adalah sebagai berikut.
- Asam-asam lemah, seperti CH3COOH, HCN, H2CO3, dan H2
- Basa-basa lemah, seperti NH4OH, dan Ni(OH)2.
- Garam-garam yang sukar larut, seperti AgCl, CaCrO4, dan PbI2.
b. Non elektrolit
Larutan nonelektrolit merupakan larutan yang tidak bisa menghantarkan arus listrik saat larut dalam air. Semakin banyak jumlah ion, maka akan semakin kuat daya hantarnya.
Berikut ini adalah beberapa contoh tarutan non elektrolit.
- Urea (CO(NH2)2)
- Sukrosa
- Gula (C12H22o11)
- Glukosa (C6H12O6)
- Alkohol (C2H5OH)
2. Reaksi Oksidasi dan Reduksi serta Tata nama Senyawa
Bilangan oksidasi (biloks) merupakan jumlah muatan negatif dan positif dalam atom, yang secara tidak langsung menandakan jumlah elektron yang telah diterima atau diserahkan.
Atom yang menerima elektron akan bertanda negatif, sedangkan atom yang melepaskan elektron bertanda positif.
a. Bilangan Oksidasi Unsur dalam senyawa atau ion
Penentuan bilangan oksidasi dari suatu atom unsur dalam senyawa atau ion mengikuti beberapa aturan sebagai berikut.
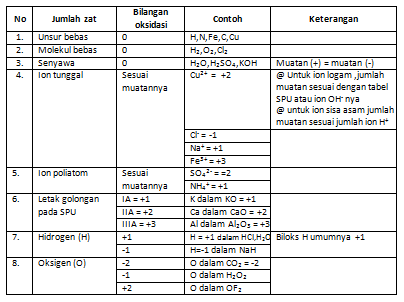
b. Reaksi Oksidasi dan Reduksi
Konsep Reaksi Oksidasi dan Reduksi
Konsep reaksi oksidasi reduksi adalah sebagai berikut.
1) Oksidasi reduksi sebagai penggabungan dan pelepasan Oksigen

2) Oksidasi reduksi sebagai reaksi pelepasan dan penerimaan elektron
3) Oksidasi Reduksi sebagai Reaksi Peningkatan dan Penurunan Bilangan Oksidasi

c. Tata Nama Senyawa
Aturan nama senyawa disusun berdasarkan aturan IUPAC (International Union of Pure and AppliiedChemistry) adalah sebagai berikut.
1) Tata Nama Senyawa Biner
Senyawa biner, yaitu senyawa yang terbentuk dari dua unsur, yang berasal dari satu unsur logam dan satu unsur non logam atau dari dua unsur non logam.
Tata Nama Senyawa Biner Logam dan Non Logam
Apablia unsur logam hanya memiliki satu bilangan oksidasi, maka unsur logam disebutkan lebih dahulu, kemudian diikuti nama unsur bukan logam yang diakhiri dengan akhiran –ida.
Tata Nama Senyawa Biner Non Logam dan Non Logam
Senyawa biner terdiri atas unsur bukan logam dan bukan logam, aturan penamaan senyawanya sebagai berikut.
Unsur yang terdapat lebih dahulu dalam urutan berikut ditulis pada bagian depan.
B – Si – C – S – As – P – N – H – S – I – Br – Cl – O – F.
Rumus kimia amonia lazim ditulis sebagai NH3 bukan H3 N dan rumus kimia air lazim ditulis sebagai H2O bukan OH2.
2) Tata Nama Senyawa Non Logam
Senyawa dari dua jenis unsur non logam dengan memberi nama sesuai nama kedua unsur yang bersangkutan dengan akhiran –ida.
3. Hukum-hukum dasar Kimia dan Stoikiometri
a. Pengertian Hukum Dasar Kimia
Berikut ini adalah beberapa hukum dasar kimia.
- Lavoisier (hukum Kekakalan Massa)
- roust (Hukum Perbandingan Tetap)
- Dalton (Hukum Perbandingan Berganda)
- Gay Lussac (Hukum Perbandingan Volume)
Materi selengkapnya dapat dibaca disini
b. Konsep mol
Hubungan Mol dengan Jumlah Partikel
1 mol zat mengandung 6,02 x 10 23 partikel, yaitu bilangan Avogadro dengan lambang L atau N.
P = n x L
Keterangan:
P = jumlah partikel (atom, ion atau molekul)
n = jumlah mol (mol)
L = tetapan Avogadro (6,02 × 1023 partikel/mol)
Hubungan mol dengan massa
Banyaknya mol untuk unsur dan senyawa:
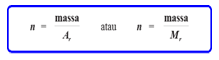
Keterangan :
n = mol unsur/senyawa
m =massa unsur/senyawa (gram)
Hubungan mol dengan volume
a. Hubungan volume gas dengan mol dengan persamaan gas ideal (STP)
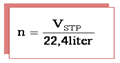
Keterangan:
n = mol unsur/senyawa
V = volume gas (STP)
b. Hubungan volume yang keadaan tidak STP
Untuk gas ideal atau suatu gas yang dianggap ideal, berlaku rumus :
PV = nRT atau v = n.R.T/ p
Keterangan :
P = tekanan (satuan atmosfer, atm)
V= volume (satuan liter, L)
n = jumlah mol gas
R = tetapan gas (0,08205 L.atm/mol.K)
T = suhu mutlak ( °C + 273 K )
Hubungan dengan konsep Mol
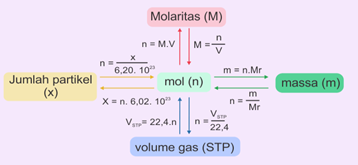
Materi selengkapnya dapat dibaca disini
Latihan Soal UKK PAT Kimia Kelas 10 SMA MA SMK Tahun 2021

Berikut dibagikan latihan soal UKK PAT Kimia kelas 10 SMA MA SMK Tahun 2021. Soal UKK PAT Kimia ini untuk referensi belajar peserta didik kelas 10 dalam menghadapi UKK Tahun Pelajaran 2020/2021.
Latihan Soal dan Kunci Jawaban UKK Kimia Kelas 10 SMA SMK MA Tahun Pelajaran 2020/2021 ini, secara lengkap dapat di unduh pada link di bawah ini.
Latihan soal kimia kelas 10 – Unduh
Kunci jawaban soal kimia kelas 10 – Unduh
Demikian yang dapat kami bagikan mengenai latihan soal UKK PAT Kimia Kelas 10 SMA MA SMK Tahun 2021 Semoga bermanfaat untuk membantu belajar peserta didik.




