Lembar Kerja Peserta Didik LKPD Kimia Materi Laju Reksi
Gurubagi.com. Berikut ini kami bagikan Lembar Kerja Peserta didik LKPD Kimia materi laju reaksi. LKPD Kimia ini untuk membantu peserta didik jenjang SMA MA dalam melakukan praktikum Kimia pada pembahasan materi dan perubahannya .
Pembelajaran dengan menggunakan Lembar Kerja Peserta Didik (LKPD) merupakan bagian penting yang tidak dapat dipisahkan dari kegiatan pembelajaran kimia SMA/MA.
LKPD merupakan merupakan metode pembelajaran yang digunakan untuk memberikan keterampilan proses pembelajaran pada peserta didik.
Oleh karena itu, LKPD Kimia ini dapat menunjang keterampilan proses pembelajaran Kimia materi dan perubahannya.
Baca :
- Lembar Kerja Peserta Didik LKPD Kimia Materi dan Perubahannya
- Lembar Kerja Peserta Didik LKPD Kimia Larutan Elektrolit dan Non Elektrolit
- Lembar Kerja Peserta Didik LKPD Kimia Materi Larutan Asam Basa
Ringkasan Materi
Laju reaksi merupakan peristiwa perubahan konsentrasi reaktan atau produk dalam satuan waktu.
Laju reaksi juga dapat dinyatakan sebagai suatu laju terhadap berkurangnya konsentrasi suatu pereaksi. Konstanta laju reaksi merupakan laju reaksi bila konsentrasi dari masing-masing jenis adalah satu.
Secara sederhana, laju reaksi diartikan sebagai perubahan konsentrasi pereaksi (reaktan) atau reaksi (produk) persatuan waktu.
Fenomena laju reaksi dalam kehidupan sehari-hari dapat berlangsung secara cepat, sedang, lambat bahkan sangat lambat.
Oleh karena itu, percobaan laju reaksi ini dilakukan agar praktikum praktikan dapat lebih memahami tentang laju reaksi dan memahami faktor-faktor yang dapat mempengaruhi laju reaksi.
Cepat lambatnya proses laju reaksi tersebut dipengaruhi oleh beberapa faktor seperti dijelaskan berikut ini.
1. Konsentrasi

Jika konsentrasi pereaksi diperbesar maka laju reaksinya juga akan menjadi semakin cepat. Hal ini terjadi sebab, zat dengan konsentrasi tinggi mengandung jumlah partikel lebih banyak dan rapat.
Dengan demikiain, antara partikel satu dengan lainnya akan sering mengalami tumbukan yang mengakibatkan terjadinya reaksi kimia.
2. Suhu

Reaksi kimia akan berlangsung lebih cepat pada suhu yang tinggi, sedangkan jika suhunya rendah maka reaksi kimia akn lebih lambat.
Sebab, ketika suhu meningkat maka energi kinetik partikel juga semakin besar, hal ini menyebabkan gerak partikel bertambah besar. Sehingga memungkinkan terjadinya tumbukan efektif antarpartikel.
Contohnya, daging sapi akan lebih awet jika disimpan di dalam lemari es (freezer) daripada dibiarkan pada suhu ruang atau kopi instan akan lebih mudah larut apabila diseduh dengan air panas daripada air dingin.
3. Luas Permukaan
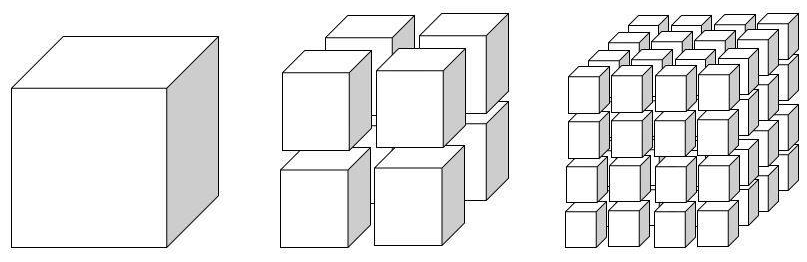
Apabila ada reaksi yang berlangsung lebih dari satu fasa, maka tumbukan antarpartikelnya terjadi di permukaan zat.
Jika permukaan zat diperbanyak dengan cara memperkecil ukuran partikel, maka laju reaksi yang dihasilkan jauh lebih cepat.
Dapat disimpulkan bahwa, semakin luas permukaan zat pereaksi maka frekuensi tumbukan semakin sering terjadi, sehingga laju reaksinya juga akan berlangsung lebih cepat. Contohnya, serbuk gula akan lebih cepat larut dalam air daripada bongkahan gula.
4.Katalis
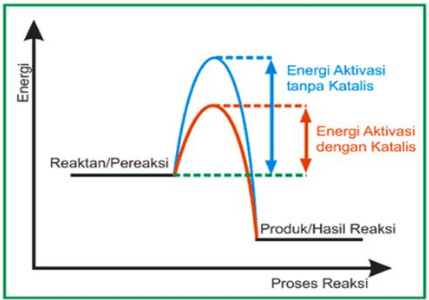
Katalis atau katalistor adalah zat yang ditambahkan untuk mempercepat laju reaksi dengan cara menurunkan energi aktivasi tanpa mengalami perubahan hingga akhir proses.
Contoh, dekomposisi amoniak dan alkohol menggunakan logam platinum serta konversi pati menjadi gula (glukosa) dengan asam atau enzim.
Berikut ini adalah contoh Lembar Kerja Peserta Didik LKPD Kimia Materi laju reaksi .
Lembar Kerja Peserta Didik Kimia Materi Laju Reaksi
A. Judul Praktikum
Indentifikasi lajurfeaksi kimia
B. Tujuan Praktikum
Mengetahui faktor-faktor yang mempengaruhi laju reaksi
C. Alat dan Bahan
1. Alat
- Tabung reaksi
- Rak tabung reaksi
- Penjepit tabung reaksi
- Kaki tiga
- Gelas ukur
- Gelas kimia
- Pipet tetes
- Spatula
- Statif dan ring
- Pembakar spiritus
- Neraca Ohauss
- Batang pengaduk
- Kawat kasa
- Thermometer
- Lumpang dan alu
- Stopwatch
2. Bahan
- Pita magnesium
- HCl 0,1 M; 0,5 M; 1 M; 2M dan 3 M
- Na2S2O3 0,1 M
- H2O2
- NaCl
- FeCl3
- Batu pualam (padat dan serbuk)
D. Petunjuk Kerja Praktikum
Identifikasi Laju reaksi
1. Pengaruh konsentrasi
- Siapkan 4 buah tabung reaksi. Lalu, masing-masing tabung diisi dengan pita magnesium.
- Masukkan HCl 0,5 M di tabung pertama, HCl 1 M di tabung kedua, HCl 2 M di tabung ketiga dan HCl 3 M di tabung keempat.
- Amati dan catat waktu pada masing-masing tabung.
2. Pengaruh luas permukaan
- Siapkan 2 buah tabung reaksi.
- Tabung pertama diisi 2 gram bongkahan batu pualam, tambahkan, tambahkan 1 ml HCl 2M.
- Tabung kedua diisi dengan 2 gram batu pualam yang telah digerus, tambahkan 1 ml HCl 2M.
- Amati laju reaksi pada kedua tabung tersebut.
3. Pengaruh suhu
- Masukkan larutan Na2S2O3 0,1 M sebanyak 15 ml ke dalam 15 ml larutan HCl 0,1 M yang diletakkan di atas kertas dan telah ditandai dengan huruf X.
- Amati dari atas hingga tanda tersebut hilang.
- Suhu larutan Na2S2O3 0,1 M dinaikkan menjadi 40°C, 50°C dan 60°C, kemudian ulangi dengan langkah yang sama untuk masing-masing perlakuan tersebut sampai tanda X tidak terlihat.
- Catat suhu awal dan akhir.
4. Pengaruh katalis
- Siapkan 3 buah tabung reaksi.
- Isi ketiga tabung dengan larutan H2O2 sebanyak 5 ml.
- Tabung pertama sebagai kontrol dan tidak ditambahkan larutan apapun.
- Tabung kedua diberi 2 tetes NaCl 0,1 M.
- Tabung Ketiga ditambahkan FeCl3 0,1 M sebanyak 4 tetes.
- Amati dan catat hasilnya.
Tabel Hasil Pengamatan

Simpulan :
…………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………….
Lembar Kerja Peserta Didik LKPD Kimia materi laju reaksi kimia dalam format PDF dapat di unduh di sini.
Demikian contoh Lembar Kerja Peserta Didik LKPD Kimia materi laju reaksi kimia. Semoga bermanfaat.