Materi Larutan Elektrolit dan Non Elektrolit Kelas 10 SMA MA SMK
Gurubagi.com. Larutan elektrolit sangat penting keberadaanya dalam kehidupan. Hal ini karena fungsi cairan elektrolit ini terkait dengan mekanisme metabolisme tubuh, seperti ion pengaktif enzim, pembentuk hormon, dan melancarkan impuls pada syaraf.
Kabel listrik yang terbuat dari tembaga merupakan zat padat yang dapat menghantarkan arus listrik. Akan tetapi, air merupakan zat cair yang juga dapat mengalirkan arus listrik.
Mengapa hal itu dapat terjadi? Untuk mendalami hal tersebut, silakan lakukan percobaan daya hantar larutan berikut.
Menguji Daya Hantar Listrik Larutan
A. Tujuan Percobaan
- Mengamati dan mempelajari perbedaan larutan elektrolit dan non elektrolit.
- Mengamati dan mempelajari jenis-jenis larutan.
- Memahami ciri-ciri larutan elektrolit dan non elektrolit.
- Mengenal beberapa larutan yang termasuk elektrolit dan non elektrolit.
- Mengetahui perbedaan larutan elektrolit kuat,elektrolit lemah dan non elektrolit.
B. Alat dan bahan

C. Langkah Kerja
- Susun alat uji elektrolit.
Masukkan masing –masing larutan yang akan kita uji kedalam gelas kimia sekitar 100 ml.
Celupkanan elektroda yang sudah di hubungkan dengan kabel penghubung ke dalam gelas kimia yang berisi larutan yang akan kita uji.
Amati nyala lampu, dan gelembung gas disekitar elektroda.
Ulangi hal tersebut untuk larutan yang lain.
6. Perlu diperhatikan sebelum menggunakan elektroda untuk larutan lain maka elektroda usahan telah dicuci besih dengan menggunakan aquades dan dilap, agar elektroda terbebas dari ion-ion dari larutan lain.
D. Hasil Pengamatan
Hasil pengamatan dapat ditulis pada tabel berikut.
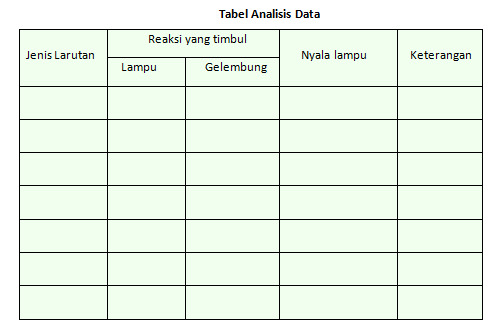
Berdasarkan hasil pengamatan tersebut, kita dapat mengetahui perbedaan larutan elektrolit dan non elektrolit.
Berikut ini adalah penjelasan materi mengenai kedua jenis larutan tersebut.
Elektrolit dan Non Elektrolit
Larutan adalah campuran homogen dua zat atau lebih yang saling melarutkan dan masing-masing zat penyusunnya tidak dapat dibedakan lagi secara fisik.
Baca ;
- Latihan Soal UKK PAT Kimia Kelas 10 SMA MA SMK Tahun 2021
- Materi Stoikiometri : Persamaan Reaksi, Contoh Soal, dan Pembahasannya
Larutan terdiri atas zat terlarut dan pelarut. Berdasarkan daya hantar listriknya (daya ionisasinya), larutan terbagi dalam dua macam, yaitu larutan elektrolit dan larutan non elektrolit.
1. Larutan Elektrolit
Larutan merupakan suatu antar zat penyusunan yang tidak memiliki bidang batas serta bersifat homogen pada semua bagian campuran.
Komponen larutan ialah pelarut dan zar terlarut. Elektrolit ialah zat yang saat dilarutkan didalam air akan mendapatkan larutan yang bisa menghasilkan arus listrik.
Berikut ini larutan terbagi menjadi dua, yaitu lektrolit kuat dan elektrolit lemah.
a. Larutan elektrolit kuat
Larutan elektrolit kuat adalah larutan yang mempunyai daya hantar listrik yang kuat, karena zat terlarutnya di dalam pelarut (umumnya air), seluruhnya berubah menjadi ion-ion (α = 1).
Berikut ini yang termasuk contoh golongan elektrolit kuat.
- Asam-asam kuat, seperti HCl, HCl03, H2SO4, dan HNO3.
- Basa-basa kuat, yaitu basa-basa golongan alkali dan alkali tanah, seperti: NaOH, KOH, Ca(OH)2, dan Ba(OH)2.
- Garam-garam yang mudah larut, seperti NaCl, KI, dan Al2(SO4)
b. Larutan Elektrolit Lemah
Larutan elektrolit lemah adalah larutan yang daya hantar listriknya lemah dengan harga derajat ionisasi sebesar 0< α < 1.
Berikut adalah contoh larutan yang tergolong elektrolit lemah.
- Asam-asam lemah, seperti CH3COOH, HCN, H2CO3, dan H2
- Basa-basa lemah seperti NH4OH, dan Ni(OH)2.
- Garam-garam yang sukar larut, seperti AgCl, CaCrO4, dan PbI2.
2. Larutan Non elektrolit
Larutan nonelektrolit merupakan larutan yang tidak bisa menghantarkan arus listrik saat dilarutkan didalam air.
Semakin banyak jumlah ion, maka akan semakin kuat daya hantarnya. Sedangkan larutan yang tidak bisa menghantarkan arus listrik disebabkan karena zat-zat itu tetap berwujud dalam molekul netral yang tidak bisa bermuatan.
Berikut ini adalah contoh larutan non elektrolit.
- Urea (CO(NH2)2)
- Sukrosa
- Gula (C12H22o11)
- Alkohol (C2H5OH)
Perbedaan Larutan Elektrolit dan Non Elektrolit
Larutan elektrolit dan non elektrolit memiliki karakteristik sifat yang berbeda. Perbedaannya adalah sebagai berikut.
Sifat larutan elektrolit :
- dapat menghantarkan listrik;
- memiliki derajat ionisasi yang berkisar antara 0 < α ≤ 1;
- pada uji elektrolit memberikan gejala : timbul gelembung gas sekitar elektroda dan lampu menyala; dan
- derajat ionisasi = 1, atau mendekati 1.
Sifat larutan non elektrolit:
- tidak dapat menghantarkan listrik, karena tidak terionisasi;
- memiliki derajat ionisasi α = 0 (tidak terionisasi); dan
- pada uji elektrolit memberikan gejala : lampu tidak menyala dan tidak menghasilkan gelembung gas pada elektroda.
Derajat ionisasi adalah parameter larutan elektrolit di mana secara matematis nilainya adalah perbandingan jumlah mol dari zat yang terionisasi dengan zat mula-mula.
Senyawa Pembentuk Larutan Elektrolit
Larutan yang dapat menghantarkan arus listrik tersusun dari senyawa ion dan kovalen polar, karena pada senyawa-senyawa tersebut dapat terionisasi ketika dilarutkan kedalam air.
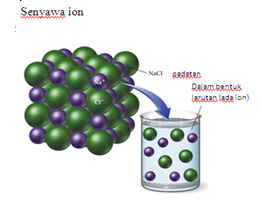
1. Senyawa ion
Senyawa ini tersusun atas ion-ion yang memiliki bentuk padat dan kering. Ion-ion yang tersusun pada senyawa ion ketika pelarutannya akan bergerak bebas, oleh karena itu larutan ion bisa menghantarkan arus listrik.
Tetapi senyawa ion yang memiliki sebuah bentuk kristal, ion-ion berbentuk kristal tidak dapat bergerak bebas, sehingga tidak dapat menghantarkan arus listrik. Contohnya pada senyawa ion, yaitu NaCl, KCl, NaOH dan KOH.
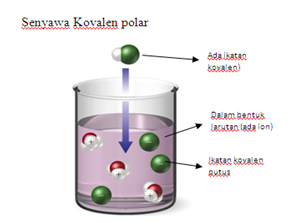
2. Senyawa Kovalen Polar
Senyawa kovalen polar, yaitu ketika suatu zat kita larutkan kedalam air, maka akan langsung terurai menjadi sebuah ion-ion.
Hal ini terjadi karena pada ikatan kovalen senyawa tersebut mudah putus kedalam pelarut air dan akan menghasilkan ion-ion. Contohnya adalah asam klorida (HCl) dan amonia (NH3)
Fungsi Larutan Elektrolit dalam Tubuh
Elektrolit adalah ion atau garam mineral yang terdapat dalam cairan tubuh untuk membantu tubuh berfungsi dengan baik dan menjaganya tetap terhidrasi. Setiap kali berkeringat, tubuh kehilangan elektrolit sehingga membuat seseorang merasa lebih haus.
Elektrolit umumnya terkandung dalam makanan dan air yang dikonsumsi sehari-hari. Garam yang berasal dari makanan dan minuman dilarutkan dalam tubuh dan diteruskan ke berbagai cairan seperti darah, urine, serta cairan seluler.
Demikian materi Kimia tentang larutan elektrolit dan non elektrolit kelas 10 SMA MA SMK. Semoga bermanfaat.