Pengertian Laju Reaksi, Rumus, dan Faktor-faktor yang Memengaruhinya
Gurubagi.com. Laju reaksi merupakan salah satu konsep dalam ilmu kimia yang sering digunakan kehidupan sehari-hari. Pengertian laju reaksi adalah adalah besarnya perubahan jumlah pereaksi dan hasil reaksi per satuan waktu.
Laju reaksi dinyatakan dengan satuan konsentrasi molar (molaritas). Oleh karena itu, laju reaksi dapat dikatakan sebagai perubahan konsentrasi akhir (hasil reaksi) terhadap konsentrasi awal (pereaksi) per satuan waktu. Molaritas sendiri merupakan ukuran yang menyatakan banyak mol zat terlarut dalam satu liter larutannya.
Pengukuran laju reaksi dapat dilakukan dengan dua cara, yaitu dengan mengukur jumlah pereaksi yang digunakan atau bereaksi persatuan waktu dan mengukur jumlah hasil reaksi yang terbentuk persatuan waktu.

Rumus Laju Reaksi
Pada reaksi kimia: A → B, maka laju berubahnya zat A menjadi zat B ditentukan dari jumlah zat A yang bereaksi atau jumlah zat B yang terbentuk per satuan waktu. Pada saat pereaksi (A) berkurang, hasil reaksi (B) akan bertambah.
Baca : Contoh Soal Kimia Laju Reaksi Kelas 11 SMA MA dan Kunci Jawabannya
Perhatikan diagram perubahan konsentrasi pereaksi dan hasil reaksi berikut

Berdasarkan gambar tersebut, maka penjelasan rumusan laju reaksi adalah sebagai berikut.
1. Berkurangnya jumlah pereaksi (konsentrasi pereaksi) per satuan waktu
![]()
dengan
- r = laju reaksi,
- – d[R] = berkurangnya reaktan (pereaksi)
- dt = perubahan waktu.
Untuk reaksi : A → B, laju berkurangnya zat A adalah :

2. Bertambahnya jumlah produk (konsentrasi produk) per satuan waktu
![]()
dengan :
+Δ[P] = bertambahnya konsentrasi produk (hasil reaksi).
Untuk reaksi : A → B, laju bertambahnya zat B adalah :

Untuk reaksi yang lebih kompleks, misalnya : pA + qB → rC, maka menggunakan persamaan berikut.

Teori Tumbukan
Menurut teori tumbukan, suatu reaksi berlangsung sebagai hasil tumbukan antarpartikel pereaksi. akan tetapi tidak semua partikel pereaksi dapat menimbulkan reaksi.
Akan tetapi, hanya tumbukan partikel yang efektiflah yang dapat menimbulkan reaksi atau tumbukan yang memiliki energi minimum serta arah tumbukan yang tepat.

Keterangan:
(a) Tumbukan yang tidak efektif (tidak terbentuk zat baru)
(b) Tumbukan yang efektif (terbentuk zat baru)
Energi minimum yang harus dimiliki partikel pereaksi, sehingga menimbulkan tumbukan efektif disebut dengan eergi aktivasi (Ea).
Semakin kecil harga energi aktivasi, maka semakin mudah reaksi terjadi. Reaksi kimia tersebut bisa terjadi karena partikel-partikel yang saling bertumbukan.
Orde Reaksi dan Persamaan Laju Reaksi
Laju reaksi dipengaruhi oleh konsentrasi pereaksi. Laju reaksi dalam suatu sistem pada suatu temperatur berbanding lurus dengan konsentrasi zat yang bereaksi, setelah tiap-tiap konsentrasi dipangkatkan dengan koefisiennya dalam persamaan reaksi yang bersangkutan.
Reaksi secara umum sebagai berikut
aA + bB → cC + dD
Persamaan laju reaksi secara umum ditulis kan dengan persamaan berikut.
v = k[A]m [B]n
Keterangan :
- v = laju reaksi
- k = tetapan laju reaksi
- [A] = konsentrasi zat A dalam mol/liter
- [B] = konsentrasi zat B dalam mol/liter
- m = orde/tingkat reaksi trhadap zat A
- n = orde/tingkat reaksi terhadap zat B
- m + n = orde reaksi total
Orde reaksi adalah bilangan yang menyatakan besarnya pengaruh konsentrasi reaktan saat terjadi laju reaksi. Pada umumnya, orde reaksi dinyatakan dalam bilangan bulat, tetapi juga bisa dalam bentuk pecahan dan bilangan negatif.
Orde ini tidak bergantung pada koefisien stoikiometri reaktan, tetapi tergantung pada nilai selama eksperimen. Ada beberapa jenis dari orde reaksi, yaitu Orde reaksi nol, Orde reaksi satu, dan Orde reaksi dua.
Contoh Soal
Perhatikan data percobaan laju reaksi NO2 + Cl2(g) → NOCl2(g) berikut.

Tentukan rumus persamaan laju reaksi di atas!
Pembahasan :
Untuk mencari persamaan laju reaksi, maka harus menghitung orde reaksi masing-masing terlebih dahulu
Orde reaksi terhadap NO, dengan mengambil data percobaan Cl2 yang memiliki konsentrasi yang sama , yaitu dengan menggunakan percobaan 2 dan 3.

m = 1
Mencari orde reksi terhadap Cl2 , menggunakan data NO yang memiliki konsentrasi yang sama yaitu menggunakan percobaan 1 dan 2.

n = 1
Oleh karena itu, persamaan laju reaksi yang benar adalah v = [NO][Cl2]
Faktor-faktor yang Mempengaruhi Laju Reaksi
Kecepatan laju reaksi dapat dipengaruhi oleh beberapa faktor. Berikut ini adalah faktor-faktor yang memengaruhi laju reaksi.
1. Konsentrasi
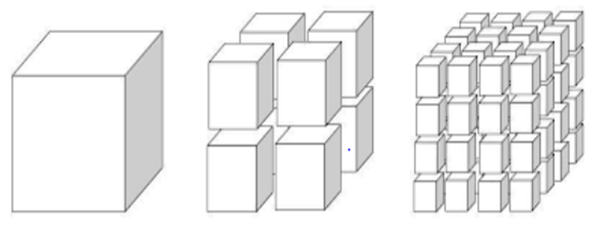
Konsentrasi merupakan jumlah partikel dari reaktan yang saling bertumbukan dalam larutan. Larutan yang pekat, artinya punya konsentrasi yang besar, punya partikel yang lebih rapat kalau kamu bandingkan dengan larutan encer.
Semakin tinggi konsentrasinya, maka semakin banyak molekul dalam tiap satuan. Hal ini berakibat tumbukan antarmolekul intensitasnya makin sering terjadi dan reaksinya berlangsung semakin cepat.
b. Luas Permukaan Sentuh
Tumbukan terjadi karena adanya bidang yang saling bertumbukan. Tumbukan terjadi karena adanya bidang saling bersentuhan.
Padatan yang bentuknya serbuk halus, punya luas permukaan bidang sentuh yang lebih besar kalau dibandingkan dengan padatan yang berbentuk lempeng atau butiran.
Dengan demikian, berlaku ketetapan bahwa semakin luas permukaan partikelnya, maka frekuensi tumbukan bisa jadi semakin tinggi. Inilah yang menyebabkan reaksi berlangsung bisa lebih cepat.
c. Suhu
Reaksi kimia umumnya lebih cepat jika dilangsungkan pada suhu yang lebih tinggi. Sebaliknya, jika suhunya rendah, maka reaksi kimia akan lebih lambat terjadi.
d. Katalis
Katalis adalah merupakan zat yang mempercepat laju reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu katalis berperan dalam reaksi tapi bukan sebagai pereaksi ataupun produk.
Dengan adanya katalis, memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya terhadap pereaksi.
Katalis menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah. Katalis mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi.
Demikian ulasan mengenai pengertian laju reaksi, rumus, dan faktor-faktor yang memengaruhinya. Semoga bermanfaat.