Persamaan Termokimia, Soal dan Pembahasannya
Gurubagi.com. Termokimia merupakan ilmu yang mempelajari reaksi kimia dan perubahan energi yang terlibat di dalamnya. Didalam termokimia juga dipelajari mengeai persamaaan termokimia
Persamaan termokimia adalah persaman rekasi setara yang menyertakan kalor reaksi (entalpi reaksi) yang menunjukkan hubungan antara massa dan energi.
Dengan kata lain persamaan termokimia merupakan persamaan reaksi yang disertai informasi tentang jumlah mol zat pereksi dan hasil reaksi (ditunjuk oleh koefisien persamaan reaksi) dan perubahan entalpi (∆H) yang menyertai reaksi tersebut.
Persamaan termokimia tidak hanya menyatakan jumlah mol reaktan dan jumlah mol produk, tetapi juga menyatakan jumlah kalor yang dibebaskan atau diserap pada reaksi itu dalam satuan kJ.
Contoh persamaan termokimia:
Pada reaksi kimia dapat terjadi reaksi eksoterm dan endoterm. Berikut ini persamaan termokimia yang terjadi pada reaksi eksoterm dan endoterm.
1.Reaksi ermksote
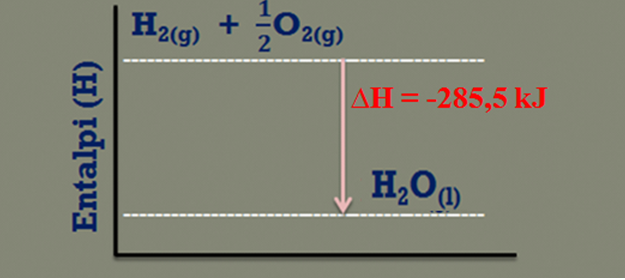
Pada reaksi pembentukan 1 mol air (H2O) dari gas Hodrogen (H2) dan gas Oksigen (O2) dilepas kalor sebesar 285,5 kJ. Persamaan termokimianya dapat dituiskan sebagai berikut:
2H2(g) + O2(g) → 2H2O(g) ΔH= −285,5 kJ
Pada reaksi di atas terjadi reaksi eksoterm (sistem melepas kalor), berarti entalpi awal sistem lebih besar dari entalpi akhir sistem atau (HH2 + HO2) > (HH2O).
Diagram energinya dapat digambarkan sebagai berikut:
2. Reakksi endoterm
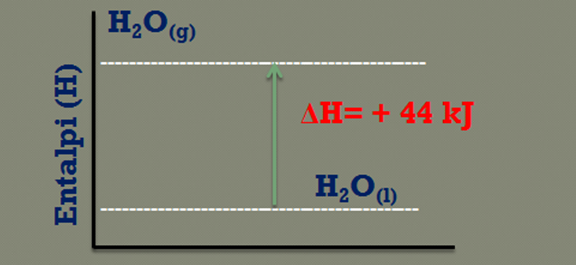
Proses penguapan air merupakan proses endoterm. Pada proses pengupan tersebut diperlukan energi sebesar 44 kJ. Persamaan termokimiaa dapat dinyatakan sebagai berikut.
H2O(l) → H2O(g) ΔH= + 44 kJ
Kalor sbesar 44 kJ diserap oleh air sehingga air bberubah menjdi uap. Dengan demikian HH2O(l) < H H2O(g).
Gambar diagran energinya dapat dilihat di bawah ini
Contoh sol dan pembahasan persamaan termokimia
Soal nomor 1
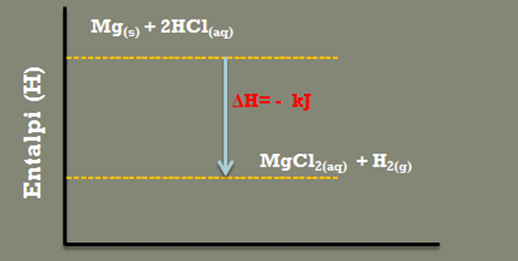
Seorang peserta didik melakukan percobaan dengan mereaksikan pita magnesium dengan larutan HCl, denga persamaan berikut :
Mg(s) + HCl((aq) → MgCl2(aq) + H2(g)
Pengukuran suhu dilakukan sebelum dan sesudah reaksi seperti gambar di bawah ini.

Perubahan entalpinya adalah x kJ
a. Tunjukan bagian yang merupakan sistem, lingkungan dan pembatas!
b. Apakah reaksi tersebut disebut reaksi eksoterm atau ndoterm? Jelaskan!
c. Tuliskan persamaan termokimia dan diagram energinya!
Pembahasan :
a. Sistemnya adalah reaksi : Mg(s) + HCl(aq) → MgCl2(aq) + H2(g)
b. Lingkungannya adalah udara sekitar reaksi.
c, Reaksi tersbut termasuk reaksi eksoterm karena suhu siste naik.
d. Persamaan termokimianya dapat dinytakan sebagai berikut :
Mg(s) + HCl(aq) → MgCl2(aq) + H2(g)
Diagram energinya dinyatakan pada gambar di bawah ini.
Baca : Persamaan Termokimia, Perubahan Entalpi Standar dan Contoh Soalnya
Soal nomor 2
Pernyataan yang benar tentang reaksi endoterm adalah ….
A. Entalpi awal lebih besar dari pada entalpi akhir dan ΔH > 0
B. Entalpi awal lebih kecil dari pada entalpi akhir dan ΔH > 0
C. Entalpi awal lebih besar dari pada entalpi akhir dan ΔH < 0
D. Entalpi awal lebih kecil dari pada entalpi akhir dan ΔH < 0
E. Entalpi awal sama dengan besar dari pada entalpi akhir dan ΔH = 0
Jawaban : B
Pembahasan :
Pada reaksi endoterm, sistem menyerap kalor. Jadi, entalpi akhir lebih besar dari pda entalpi awal.
ΔH = ΔH akhir – ΔHawal
Karena menyerap kalor maka H akhir > H awal sehingga ΔH positif (ΔH > 0)
Demikian Persamaan Termokimia, soal dan Pembahasannya. Semoga bermanfaat.