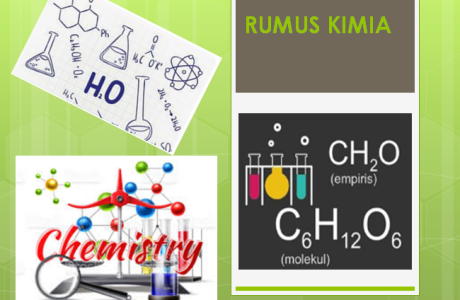
Stoikiometri : Massa Atom Relatif (Ar) dan Massa Molekul Relatif (Mr)
Gurubagi.com. Materi stoikiometri merupakan dasar dari perhitungan kimia, seperti massa atom relatif (Ar) dan massa molekul relatif (Mr) yang menyatakan relasi kuantitatif rumus kimia dan persamaan kimia.
Materi stoikiometri kelas 10 ini dintaranya membahas massa atom relatif (Ar) dan massa molekul relatif (Mr), selain itu stoikiometri juga membahas rumus empiris dan rumus molekul.
Baca : Tata Nama Senyawa Anorganik dan Organik Serta Contoh Soalnya
1. Massa Atom Relatif (Ar)
Massa atom relatif merupakan massa rata-rata suatu atom dibagi dengan massa atom acuan, yaitu atom C-12.
Rumus untuk mencari massa atom relatif suatu unsur ialah sebagai berikut adalah.
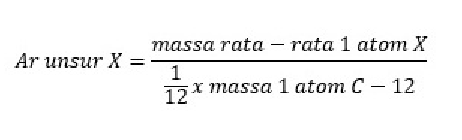
IUPAC telah menetapkan 1 sma = 1/12 massa satu atom C-12 isotop Atom H mempunyai kerapatan 8,4000% dari kerapatan C-12. Jadi massa atom H = 0,08400 x 12,00 sma=1,008 sma.
Contoh Soal :
Suatu atom X memiliki massa rata-rata 12 x 10-23 gr . jika 1 atom C-12 memiliki massa sebesar 2 x 10-23 , maka tentukan Ar dari atom X tersebut!
Pembahasan:
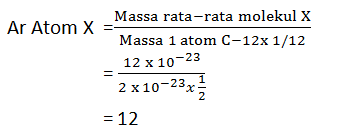
2. Massa Molekul Relatif (Mr)
Massa molekul reatif merupakan massa rata-rata molekul dibagi dengan masa atom acuan, yaitu atom C-12.
Rumus untuk mencari massa molekul relatif suatu molekul adalah sebagai berikut.

Contoh:
Suatu molekul X memiliki massa rata-rata 14 x 10.-23 gr . jika 1 atom C-12memilikimassa sebesar2 x 10-23 , maka tentukan Mr dari molekul X tersebut!
Pembahasan:
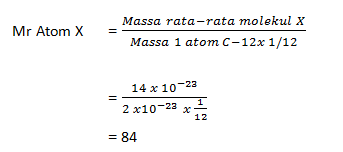
Penerapan latihan soal Ar dan Mr
- Jika diketahui massa atom unsur Fe = 55,847 sma dan massa 1 atom C-12 = 12,000 sma, maka tentukan Ar Fe!
Pembahasan:

2. Jika diketahui massa atom relatif (Ar) dari atom B adalah 36 dan massa 1 atom 12C adalah 12 sma. Tentukan massa rata-rata 1 atom B dalam satuan sma!
Pembahasan:

3. Massa molekul senyawa X adalah 14,66 x 1023 gram. Tentukanlah massa molekul relatif senyawa tersebut! (massa 1 atom unsur C-12 adalah 1,993 x 1023 gram).
Pembahasan:

Mr senyawa X = 88,313, sehingga dapat diketahui massa molekul relatif unsur X adalah 88,313.
4. Hitunglah nilai yang terkandung dalam massa molekul relatif (Mr) dari senyawa Fe2(SO4)3, jika massa atom relatif unsur masing-masing r Fe = 56, O = 16, dan S = 16).
Hitunglah massa atom relatif Fe dalam!
Pembahasan:
Mr SO4 = ( 3xAr S) + (12xAr O)
= (2x 56) + (3x 32) + (12×16) = 400
Jika Mr Fe2(SO4)3 = 400, maka massa 1 molekul Fe2(SO4)3 = 400 sma=400 x 1,66 x 10-24 gram
5. Jika massa atom relatif (Ar) masing-masing unsur Ba = 137, S = 16, dan O = 16 Berapakah, Mr dari senyawa dengan rumus kimia BaSO₄?
Pembahasan:
BaSO₄
Mr BaSO₄ = (1 x Ar Ba) + (1 x Ar S) + (4. x Ar O)
= (1 x 137) + (1 x 32) + (4 x 16)
= 137 + 32 + 64 = 233
Rumus Empiris Dan Rumus Molekul
Rumus kimia terbagi menjadi dua, yaitu rumus empiris dan rumus molekul. Perbandingan yang paling sederhana dari suatu molekul disebut rumus empiris dan rumus molekul. Rumus ini menyatakan perbandingan jenis dan jumlah paling sederhana dari suatu senyawa.
- Menentukan perbandingan massa atom-atom penyusun senyawa, bila diketahui dalam bentuk persen maka harus diubah dalam bentuk pecahan.
- Mengubah perbandingan massa menjadi perbandingan mol, yaitu dengan membagi massa atom dengan Ar masing-masing.
- Perbandingan mol atom-atom tersebut merupakan rumus empiris senyawa.
Rumus empiris dan rumus molekul bisa dijabarkan sebagai berikut:
(Rumus Empiris)n = Rumus Molekul
Contoh Penerapan Rumus Empiris dan Molekul
- Tentukan rumus empiris senyawa yang mengandung 75% karbon dan 25% atom hidrogen! (Ar C = 12, H = 1)
Pembahasan:
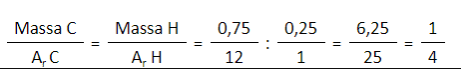
Jadi perbandingan mol C : mol H = 1 : 4. Dengan demikian, rumus empiris senyawa tersebut adalah CH4.
2. Suatu senyawa mengandung 92 gram natrium; 64 gram belerang dan 128 gram Oksigen. Tentukan rumus empiris senyawa tersebut! (Ar Na = 23, Ar S = 32, O = 16).
Pembahasan:
Rumus empiris = mol Na : mol S : mol O
= 4 : 2 : 8 (masih bisa dibagi 4)
= 2 : 1 : 4
Rumus empiris = Na2SO4
3. Suatu senyawa terdiri dari 60% karbon, 5% hidrogen, dan sisanya nitrogen. Mr senyawa itu adalah 80 gram mol-1 (Ar C = 12, H = 1, dan N = 14). Tentukanlah rumus empiris dan molekul senyawa tersebut!