Tata Nama Senyawa Anorganik dan Organik Serta Contoh Soalnya
Gurubagi.com. Setiap senyawa memiliki nama spesifik atau tata nama senyawa. Untuk memudahkan pengenalan tatanama senyawa anorganik dan organik, maka harus mengikuti aturan IUPAC (International Union of Pure and Aplplied Chemistry).
Berikut ini penjelasan mengenai tata nama senyawa anorganik dan organik serta contoh soalnya.
Senyawa Anorganik
1. Senyawa Ion
Tata nama senyawa ion adalah senyawa yang terbentuk dari unsur logam (kation) dan non logam (anion).
a. Penulisan senyawa ion biner
Senyawa biner artinya senyawa yang terdiri dari dua atom, yaitu atom logam (kation) dan nonlogam (anion).
Baca : Latihan Soal Online Kimia Materi Reaksi Redoks Kelas 10 SMK MA
Aturan penulisan tata nama senyawa ion biner adalah sebagai berikut.
- Unsur pertama tulis sesuai dengan nama unsur tersebut.
- Unsur kedua tulis sesuai dengan nama unsur tersebut tambahkan dengan akhiran –ida.
Contoh :

Jika unsur logam mempunyai lebih dari satu jenis bilangan oksidasi (pada logam golongan B), maka untuk membedakan senyawanya dengan menuliskan bilangan oksidasi, dalam tanda kurung dengan angka Romawi di belakang nama unsur logam tersebut.
Contoh :
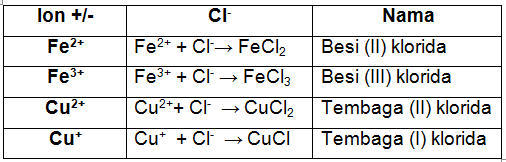
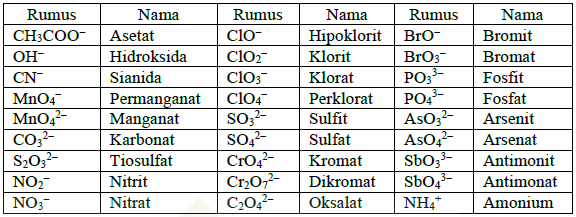
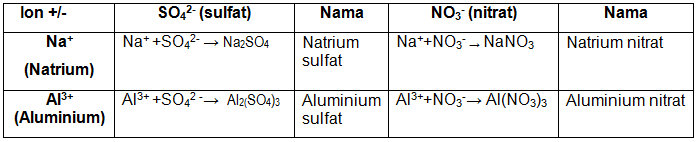
b. Penulisan senyawa ion poliatom
Ion-ion terbagi menjadi dua, yaitu ion atom tunggal (monoatom) dan ion yang tersusun dari beberapa unsur (poliatom). Aturan penamaan senyawa ion poliatom adalah dengan menuliskan nama kation, selanjutnya nama anionnya.
Berikut adalah contoh ion poliatom.
Contoh soal penulisan senyawa ion poliatom.
 2. Tata Nama Senyawa Asam Basa
2. Tata Nama Senyawa Asam Basa
a. Asam
Menurut Arrhenius, asam adalah zat yang ketika larut alam air akan menghasilkan ion H+. Semua asam awali dengan hidrogen, kecuali asam organik dan air. Tata nama senyawa asam menggunakan awalan kata asam ikuti dengan nama ion negatif (anion).
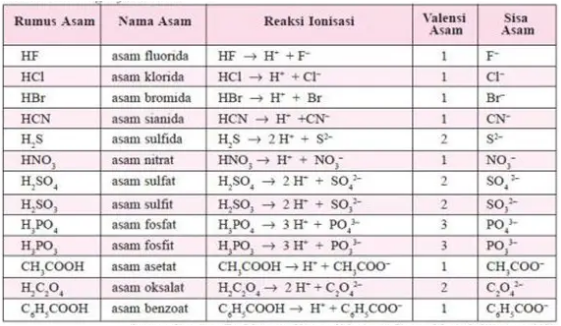
Berikut adalah contoh penamaan senyawa asam.

Rumus molekul dan nama dari beberapa senyawa asam yang lazim ada dalam laboratorium dan kehidupan sehari-hari.
b. Basa
Menurut Arrhenius, senyawa basa adalah zat yang ketika larut dalam air akan menghasilkan ion OH-. Aturan penulisan senyawa basa, yaitu dengan menuliskan nama kation dikuti dengan kata hidroksida.
3. Tata Nama Senyawa Kovalen
Senyawa kovalen terdiri dari dua unsur non logam. Aturan penulisan senyawa kovalen adalah sebagai berikut.
Untuk senyawa yang terdiri dari unsur non logam dan non logam, non logam unsur kedua dengan tambahkan akhiran –ida.
Rumus Senyawa
Di dalam menuliskan rumus senyawa, maka unsur yang terdapat lebih dahulu dalam urutan berikut ditulis paling depan.
B – Si – C – S – As – P – N – H – S – I – Br – Cl – O – F
Rumus kimia amonia lazim ditulis sebagai NH3 bukan H3N, sedangkan rumus kimia air lazim ditulis sebagai H2O bukan OH2 .
Contoh tata nama senyawa kovalen yang terdiri dari atom non logam dan nonlogam adalah sebagai berikut.

Jika dua jenis nonlogam dapat membentuk lebih dari satu macam senyawa, maka menggunakan awalan Yunani. Indeks 1 (mono) tidak perlu menuliskannya, kecuali untuk karbon monoksida.
| 1 | = | mono | 6 | = | heksa | |
| 2 | = | di | 7 | = | hepta | |
| 3 | = | tri | 8 | = | okta | |
| 4 | = | tetra | 9 | = | nona | |
| 5 | = | penta | 10 | = | deka |
Contoh soal :
Tuliskan nama dari senyawa N2O5!
Jawab :
Indek 2 pada unsur N (nitrogen) ditulis di, sedangkan indeks 5 pada O (oksigen) ditulis penta.
Jadi, nama lengkap untuk N2O5 adalah dinitrogen pentaoksida.
Senyawa Organik
Senyawa organik dibedakan menjadi senyawa sederhana (hanya terdiri atom C dan H) dan senyawa kompleks (mengandung C, H, O, N dengan rantai bercabang atau melingkar).
Tabel berikut menyajikan contoh penamaan beberapa senyawa organik sederhana golongan alkana.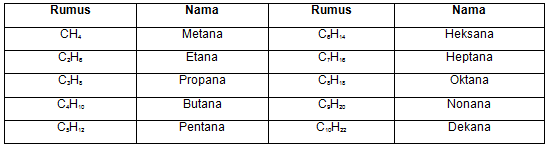
Demikian penjelasan mengenai materi tata nama senyawa anorganik dan organik serta contoh soalnya. Semoga bermanfaat.
 2. Tata Nama Senyawa Asam Basa
2. Tata Nama Senyawa Asam Basa