Pengertian Bilangan Kuantum, Bentuk Orbital, Soal, dan Pembahasannya
Gurubagi.com. Elektron mengelilingi inti atom menurut lintasan tertentu. Elektron-elektron tersebut tersebar di sekeliling atom dengan teratur berdasarkan tingkat energinya.
Tingkat energi inilah dalam mekanika kuantum terkenal dengan nama bilangan kuantum. Teori mekanika kuantum menggunakan empat bilangan untuk menyatakan suatu orbital.
Pengertian bilangan kuantum merupakan gambaran kedudukan atau lokasi-lokasi penyebaran elektron dalam suatu atom.
Posisi elektron sekitar inti atom dapat ditentukan dengan menggunakan bilangan kuantum. Tingkat energi digambarkan berdasarkan empat bilangan kuantum tersebut, yaitu sebagai berikut.
1. Bilangan kuantum utama (n)
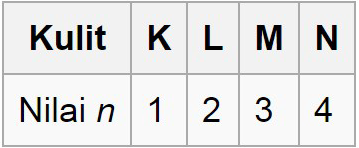
Bilangan kuantum utama (n) menunjukkan posisi elektron dalam kulit elektron, jarak rata-rata elektron dari inti dan menyatakan tingkat energi.
Energi terendah mulai dari kulit kulit K, sedangkan energi yang lebih tinggi dengan nama kulit L, M, N, dan seterusnya.
Berikut ini gambaran bilangan kuantum utama pada kulit elektron.
2. Bilangan kuantum azimut (l)
Bilangan kuantum azimut menggambarkan sub kulit atau sub tingkat energi utama serta bentuk orbital dari elektron, yaitu pengertian dari kuantum azimut (l).
Baca :
- Konfigurasi Elektron, Diagram Orbital, Contoh Soal, dan Pembahasannya
- Struktur Atom : Nomor Atom, Nomor Massa, Isotop, dan Contoh Soalnya
Bilangan ini berguna untuk menunjukkan bentuk orbital dan sub tingkatan energi elektron. Bilangan kuatum azimut (l) menyatakan nama subkulit.
Subkulit tersebut antara lain orbital:
- s (sharp).
- p (principle).
- d (diffuse).
- f (fundamental).
Bilangan kuantum ini memiliki nilai dengan ketentuan sebagai berikut.

3. Bilangan kuantum magnetik (m)
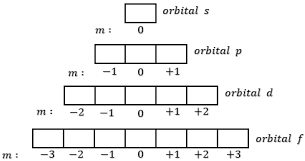
Bilangan kuantum magnetik memiliki simbol huruf m, sebagai bilangan yang menunjukkan posisi orbital terhadap orbital lain pada subkulit atom dengan ketentuan sebagai berikut.
4. Bilangan kuantum spin (s)
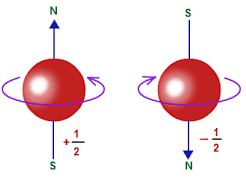
Bilangan kuantum spin (s) berfungsi untuk menunjukkan arah putaran elektron pada sumbunya (rotasi) dengan arah berlawanan jarum jam atau searah jarum jam.
Satu orbital hanya bisa ditempati oleh maksimum dua elektron, sedangkan elektron tersebut harus memiliki spin yang berlawanan.
Kedua arah yang berbeda ini menggunakan simbul spin yang nilainya +½ untuk panah ke atas atau -½ untuk panah kebawah.
Bentuk Orbital
Orbital merupakan sebuah ruang dan tempat yang mungkin bisa ditempati oleh sebuah atom. Bentuk orbital bergantung pada bilangan kuantum azimut (l), Jadi apabila suatu elektron memiliki bilangan kuantum azimut sama.
Karena memiliki bilangan kuantum azimut yang sama, maka bentuk orbitalnya juga sama, sehingga yang membedakan hanyalah tingkat energinya.
Berikut penejlasan mengenai bentuk dan orientasi dari orbital s, p,d, f.
1. Orbital s
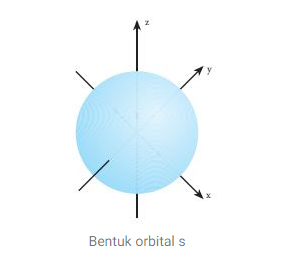
Orbital s merupakan orbital yang paling sederhana, Setiap sub kulit s terdiri atas 1 buah orbital yang berisi dua elektron.
Bentuk orbital s seperti bola simetri yang menunjukan bahwa elektron memiliki kerapatan yang sama, jika jarak dari inti atom sama juga.
Semakin jauh letak elektron dari ini, maka kerapatannya akan semakin rendah. Sedangkan semakin besar nilai bilangan kuantum utama, ukuran orbitalnya juga semakin besar.
2. Orbital p
Orbital p memiliki dua cuping seperti balon terpilin dengan satu simpul bidang melalui intinya. Setiap subkulit p (l=1), terdiri atas 3 orbital yang setara. Setiap orbital tersebut mimiliki nama px, py, pz sesuai dengan orientasinya dalam ruang.
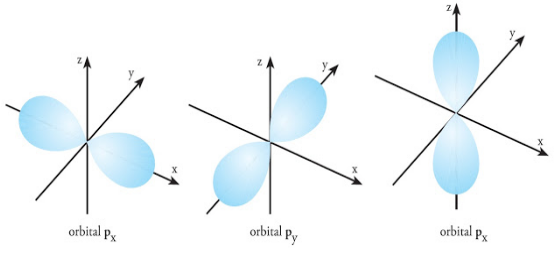
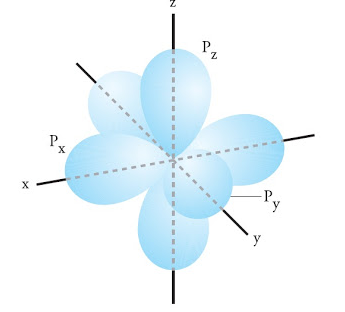
Subkulit p ini memiliki 3 nilai m, yaitu : –1, 0, dan +1, sehingga terdapat 3 orientasi yang satu dan lainnya membentuk sudut 90 o.
Berikut ini adalah gambarannnya.
3. Orbital d dan f
Orbital d memiliki 5 orbital, dimana 4 orbital d memiliiki bentuk yang sama dan masing-masing memiliki 4 cuping bagaikan gabungan dari balon terpilin.
Empat orbital tersebut, yaitu dxy, dxz, dyz, dx2y2 sedangkan satu orbital memiliki bentuk yang berbeda, yaitu dz2.
Untuk lebih jelasnya, perhatikan gambar orbital setiap sub kulit d berikut ini.
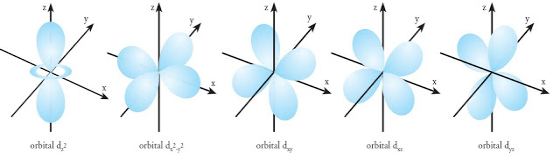
Perbedaannya dari orbital sub kulit ini terletak pada arah berkumpulnya kepadatan elektron. Meskipun terdapat satu orbital yang mempunyai bentuk berbeda, akan tetapi memiliki energi yang sama dengan keempat orbital d lainnya.
4. Orbital f
Orbital f memiiki bentuk yang lebih rumit dan lebih sulit untuk dipaparkan. Setiap sub kulit f terdiri atas 7 orbital sesuai dengan 7 harga m untuk l = 3
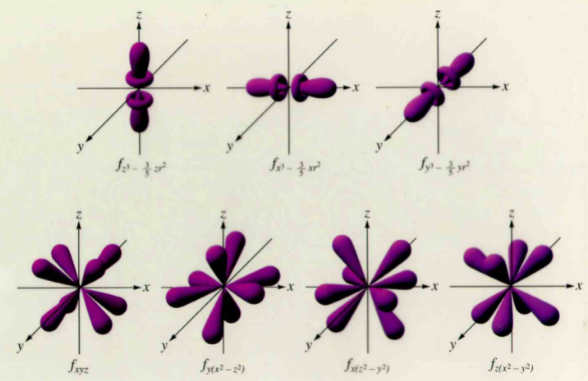
Soal dan Pembahasan Bilangan Kuantum
Tentukan keempat bilangan kuantum untuk elektron terakhir dari atom:
1. 18Ar
2. 35Cl
3. 27Co
Pembahasan:
Tuliskan terlebih dahulu konfiurasi elektron masing-masing unsur sebelum mencari ke-empat bilangan kuantum.
1. 18Ar : [Ne] 3s 2 3p6
Perhatikan orbital yang paling akhir , yaitu 3p6 keempat bilangan kuantum tersebut dapat dicari dari orbital tersebut, sehingga dapat dicari:
n = 3;
l = 1;
Mencari m dengan menggunakan susunan orbital dalam subkulit berikut:
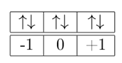
maka m = -1
s = – ½
2. 35Cl = [Ar] 4s2 3d10 4p5
Perhatikan orbital yang paling akhir , yaitu 4p5 keempat bilangan kuantum tersebut dapat dicari dari orbital tersebut, sehingga dapat dicari:
n = 4
l = 1
Mencari m dengan menggunakan susunan orbital dalam subkulit berikut:
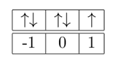
m = 0
s = -1/2
3. 27Co : [Ar] 4s2 3d7
Perhatikan orbital yang paling akhir , yaitu 3d7 keempat bilangan kuantum tersebut dapat dicari dari orbital tersebut, sehingga dapat dicari:
n = 3
l = 3
Mencari m dengan menggunakan susunan orbital dalam subkulit berikut:
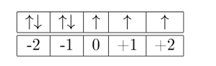
maka m = -1
s = -1/2
Demikian pengertian bilangan kuantum, bentuk orbital, soal, dan pembahasannya. Semoga bermanfaat.