Pengertian Ikatan Ion dan Ikatan Kovalen Serta Contohnya
Gurubagi.com. Ketika suatu atom ingin mencapai kestabilan, maka akan berusaha menstabilkan diri agar ekletron terluar berjumlah dua (duplet) atau delapan (oktet), seperti atom-atom unsur gas mulia.
Kemampuan suatu atom untuk mencapai kestabilan dapat dilakukan dengan dua cara, yaitu melepas atau menerima elektron pada kulit terluar, dengan ketentuan sebagai berikut.
- Jika elektron valensi 1, 2, atau 3, maka atom melepas elektron.
- Apabila elektron valensi 4, 5, 6, atau 7, maka atom menangkap elektron.
- Jika elektron valensi 8, maka elektron stabil.
Caranya adalah menggunakan teknik ikatan ion atau ikatan kovalen.
Di dalam mencapai kestabilan, atom-atom akan bergabung menjadi senyawa dengan atom lain dan menimbulkan gaya tarik menarik antar atom tersebut.
Baca :
- Teori Lewis, Struktur Lewis, Contoh Soal, dan Pembahasannya
- Pengertian Ikatan Ion dan Ikatan Kovalen Serta Contohnya
Gaya tarik menarik antar atom inilah yang disebut dengan ikatan kimia. Ikatan kimia suatu atom dapat berupa ikatan ion dan ikatan kovalen.
Berikut ini adalah penjelasan mengenai ikatan ion dan ikatan kovalen.
1. Ikatan Ion
Ikatan ion (elektrovalen) adalah ikatan yang terjadi antara ion positif dan ion negatif dalam suatu senyawa, dan terjadi serah terima elektron dari satu atom ke atom lain.
Pada umumnya ikatan ion terbentuk antara atom logam yang mudah melepaskan elektron (ion positif) dengan atom nonlogam yang mudah menangkap elektron (ion negatif).
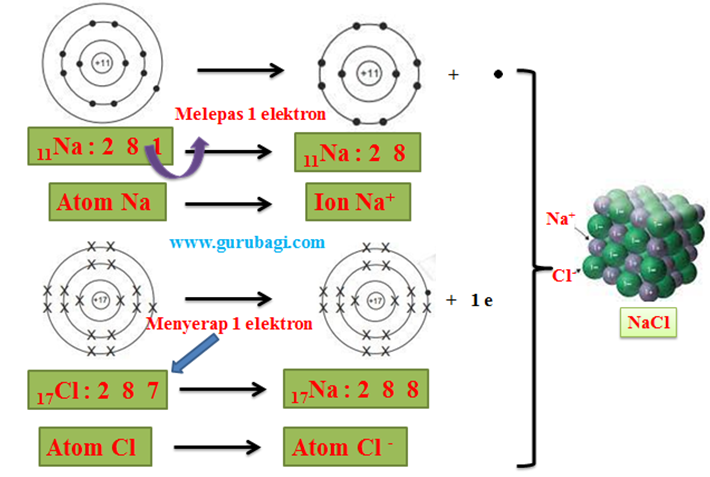
Pada pembentukan garam NaCl, atom Na melepas elektron membentuk ion positif , sedangkan elektron yang dilpas diterima oleh unsur Cl membentuk ion negatif.
NaCl (11Na dan 17Cl).
11Na : 2 8 1, Elektron valensi 1; melepas 1 elektron; Gol. IA
17Cl : 2 8 7, Elektron valensi 7; menangkap 1 elektron; Gol VIIA
Reaksi :
Na+ + Cl– → NaCl
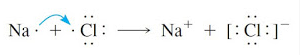
2. Ikatan Kovalen
Pembentukan ikatan kovalen terjadi karena penggunaan bersama elektron. Secara umum, ikatan ion terjadi pada ikatan atom non logam dan non logam.
Atom-atom non logam cenderung menerima elektron yang menyebabkan antara atom nonlogam saling berikatan membentuk pasangan elektron bersama untuk mencapai kestabilan.
Untuk membentuk Ikatan kimia terdapat pasangan elekrton yang dipakai bersama atau Pasangan Elektron Ikatan (PEI) dan pasangan elektron valensi yang tidak terlibat dalam pembentukan yang biasa disebut Pasangan Elektron Bebas (PEB).
Struktur Lewis dapat menggambarkan ikatan kimia yang terjadi antar atom tersebut, dengan, diamna PEI dapat ditulis garis, sedangkan PEB tetap simbol titik.
Jenis-jenis Ikatan Kovalen.
a. Ikatan Kovalen Tunggal
Ikatan kovalen tunggal, yaitu ikatan yang memiliki 1 pasangan PEI. Berikut ini adalah contoh ikatan kovalen tunggal.
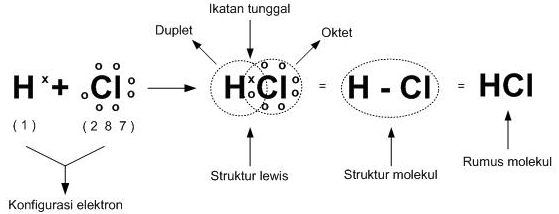
Atom H memiliki 1 elektron valesi dan Cl memiliki 7 elektron valesi, Atom H dan Cl saling serah terima elektron. Penggunaan bersama elektron ini untuk mengikuti kaidah oktet, dan membetuk ikatan kovalen tunggal .
b. Ikatan Kovalen Rangkap Dua
Ikatan kovalen rangkap dua, yaitu ikatan kovalen yang memiliki 2 pasangan PEI. Berikut ini contoh gambaran pembentukan ikatan kovalen pada atom oksigen.
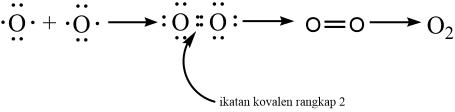
Ikatan yang terdapat dalam molekul O2 merupakan iakatan kovalen rangkap dua. Dengan nomor atom 8, oksigen mempunyai konfigurasi elektron 2 . 6 pada kulit atomnya.
Dengan demikian oksigen memiliki 6 elektron valensi, maka berarti memerlukan 2 elektron untuk mencapai kestabilan.
c. Ikatan Kovalen Rangkap Tiga
Ikatan kovalen rangkap tiga adalah ikatan yang memiliki 3 pasangan PEI. Berikut ini contoh ikatan kimia yang memiliki ikatan kovalen rangkap tiga, yaitu N2.
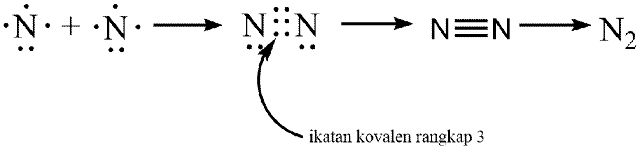
Nitrogen (N) dengan nomor 7, nitrogen mempunyai susunan elektron 2. 5 pada kulit-kulit atomnya. N mempunyai 5 elektron valensi, sehingga perlu 3 elektron lagi supaya stabil seperti susunan elektron gas mulia.
3. Ikatan Kovalen Koordinasi
Ikatan kovalen koordinasi merupakan ikatan karena adanya penggunaan bersama elekron, yang elektronnya hanya berasal dari salah satu atom berikatan, Jenis ikatan ini biasanya dengan menggunakan simbul tanda panah ( → ).
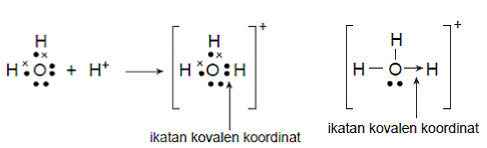
Pada molekul H3O+ terlihat antara atom O dengan atom H menggunakan elektron dengan simbol yang sama.
Elektron tersebut hanya berasal dari atom O, akan tetapi digunakan untuk berikatan,maka ikatan tersebut dinakaman ikatan kovalen koordinat.
Demikian ulasan mengenai pengertian ikatan ion dan ikatan kovalen serta contohnya. Semoga bermanfaat.